题目内容
某小组同学欲探究NH3催化氧化反应,按图1装置进行实验.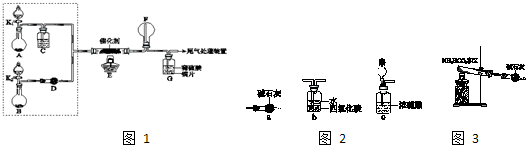
A、B装置可选药品:浓氨水、H2O2、蒸馏水、NaOH固体、MnO2
(1)NH3催化氧化的化学方程式是______.
(2)装置B中产生气体的原因有(结合化学用语解释)______.
(3)甲乙两同学分别按上述装置进行实验.一段时间后,装置G中溶液都变成蓝色.
①甲观察到装置F中有红棕色气体,生成红棕色气体的化学方程式是______.
②乙观察到装置F中只有白烟生成,白烟的成分是(写化学式)______.
③用离子方程式解释装置G中溶液变成蓝色的原因:______.
(4)如图2,为帮助乙实现在装置F中也观察到红棕色气体,可在原实验的基础上进行改进.
①甲认为可调节K1和K2控制A、B装置中的产气量,应(填“增加”或“减少”)______装置A中的产气量,或(填“增加”或“减少”)______装置B中的产气量.
②乙认为可在装置E、F间增加一个装置,该装置可以是(填序号)______.
(5)为实现该反应,也可用图3所示的装置替换上述
装置中虚线框部分,化合物X为______. NH4HCO3的作用是______.
解:(1)氨的催化氧化反应,氨气中-3价的氮被氧气氧化成显+2价的一氧化氮,化学反应方程式为:4NH3+5O2 4NO+6H2O,
4NO+6H2O,
故答案为:4NH3+5O2 4NO+6H2O;
4NO+6H2O;
(2)B装置是氨水滴入到氢氧化钠固体上,NaOH固体溶于水放出大量热,氨气在温度高的情况下溶解度小,在氨水中存在平衡:NH3+H2O?NH3?H2O?NH4++OH-,平衡向左移动;加入NaOH固体,氢氧化钠电离出氢氧根离子,OH-浓度增加,平衡向左移动,
故答案为:在氨水中存在平衡:NH3+H2O?NH3?H2O?NH4++OH-,加入NaOH固体,OH-浓度增加,平衡向左移动,NaOH固体溶于水放出大量热,均有利于NH3逸出;
(3)①氨气发生了催化氧化的产物一氧化氮,一氧化氮极易和氧气化合为二氧化氮,即2NO+O2=2NO2;所以装置F中有红棕色气体产生,
故答案为:2NO+O2═2NO2;
②乙观察到装置F中只有白烟生成,白烟是由于氨气和硝酸反应NH3+HNO3=NH4NO3,生成了白色的NH4NO3固体,
故答案为:NH4NO3;
③在装置G中,生成的二氧化氮和水反应生成硝酸和一氧化氮,化学方程式为:3NO2+H2O═2HNO3+NO,获得硝酸,金属铜和硝酸反应,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O实质是:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(4)①为了氧化氨气,氧气需过量,需增加氧气的量,减少氨气的量,A为制氧气的装置,增加A中氧气的量,装置A中的产气量,装置B中的产气量,
故答案为:增加; 减少;
②E装置是氨气的催化氧化装置,从装置中出来的气体中有氧气和氨气和一氧化氮和水蒸气,因4NO+2H2O+3O2=4HNO3,NH3+HNO3=NH4NO3,所以避免F中生成硝酸铵,实现在F中看到红棕色的二氧化氮,需除去水或氨气,需在装置E、F间增加一个装置,该装置可以将氨气或水除去,a碱石灰吸收水蒸气,可以通过防倒吸的b装置吸收氨气,可以通过浓硫酸吸收氨气和水蒸气,实现在F中看到红棕色的二氧化氮,需选abc,
故答案为:abc;
(5)为实现2NO+O2═2NO2该反应,须生成氧气,碳酸氢铵受热分解生成氨气和水和二氧化碳,放出的CO2和H2O与Na2O2反应生成O2,
故答案为:Na2O2;NH4HCO3分解放出NH3;同时放出的CO2和H2O与Na2O2反应生成O2;
分析:(1)氨的催化氧化产物是一氧化氮和水,据此来书写反应方程式;
(2)根据化学平衡移动的影响因素解答;
(3)①氨气发生了催化氧化的产物一氧化氮极易和氧气化合为二氧化氮;
②氨气和硝酸反应生成硝酸铵;
③二氧化氮和水反应获得硝酸,铜和硝酸反应生成硝酸铜、一氧化氮和水;
(4)①为了氧化氨气,氧气需过量,需增加氧气的量,减少氨气的量;
②在F中看到红棕色的二氧化氮,避免生成硝酸铵,需不买呢生成硝酸,需除去水或氨气,在装置E、F间增加一个装置,该装置可以是将氨气或水除去,剩下一氧化氮和未反应的氧气;
(5)根据反应须制取氧气,可根据可选的药品结合装置解答;
点评:本题主要考查了氨气的催化氧化,解答须掌握该反应的原理和相关物质的性质,题目难度中等.
 4NO+6H2O,
4NO+6H2O,故答案为:4NH3+5O2
 4NO+6H2O;
4NO+6H2O;(2)B装置是氨水滴入到氢氧化钠固体上,NaOH固体溶于水放出大量热,氨气在温度高的情况下溶解度小,在氨水中存在平衡:NH3+H2O?NH3?H2O?NH4++OH-,平衡向左移动;加入NaOH固体,氢氧化钠电离出氢氧根离子,OH-浓度增加,平衡向左移动,
故答案为:在氨水中存在平衡:NH3+H2O?NH3?H2O?NH4++OH-,加入NaOH固体,OH-浓度增加,平衡向左移动,NaOH固体溶于水放出大量热,均有利于NH3逸出;
(3)①氨气发生了催化氧化的产物一氧化氮,一氧化氮极易和氧气化合为二氧化氮,即2NO+O2=2NO2;所以装置F中有红棕色气体产生,
故答案为:2NO+O2═2NO2;
②乙观察到装置F中只有白烟生成,白烟是由于氨气和硝酸反应NH3+HNO3=NH4NO3,生成了白色的NH4NO3固体,
故答案为:NH4NO3;
③在装置G中,生成的二氧化氮和水反应生成硝酸和一氧化氮,化学方程式为:3NO2+H2O═2HNO3+NO,获得硝酸,金属铜和硝酸反应,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O实质是:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(4)①为了氧化氨气,氧气需过量,需增加氧气的量,减少氨气的量,A为制氧气的装置,增加A中氧气的量,装置A中的产气量,装置B中的产气量,
故答案为:增加; 减少;
②E装置是氨气的催化氧化装置,从装置中出来的气体中有氧气和氨气和一氧化氮和水蒸气,因4NO+2H2O+3O2=4HNO3,NH3+HNO3=NH4NO3,所以避免F中生成硝酸铵,实现在F中看到红棕色的二氧化氮,需除去水或氨气,需在装置E、F间增加一个装置,该装置可以将氨气或水除去,a碱石灰吸收水蒸气,可以通过防倒吸的b装置吸收氨气,可以通过浓硫酸吸收氨气和水蒸气,实现在F中看到红棕色的二氧化氮,需选abc,
故答案为:abc;
(5)为实现2NO+O2═2NO2该反应,须生成氧气,碳酸氢铵受热分解生成氨气和水和二氧化碳,放出的CO2和H2O与Na2O2反应生成O2,
故答案为:Na2O2;NH4HCO3分解放出NH3;同时放出的CO2和H2O与Na2O2反应生成O2;
分析:(1)氨的催化氧化产物是一氧化氮和水,据此来书写反应方程式;
(2)根据化学平衡移动的影响因素解答;
(3)①氨气发生了催化氧化的产物一氧化氮极易和氧气化合为二氧化氮;
②氨气和硝酸反应生成硝酸铵;
③二氧化氮和水反应获得硝酸,铜和硝酸反应生成硝酸铜、一氧化氮和水;
(4)①为了氧化氨气,氧气需过量,需增加氧气的量,减少氨气的量;
②在F中看到红棕色的二氧化氮,避免生成硝酸铵,需不买呢生成硝酸,需除去水或氨气,在装置E、F间增加一个装置,该装置可以是将氨气或水除去,剩下一氧化氮和未反应的氧气;
(5)根据反应须制取氧气,可根据可选的药品结合装置解答;
点评:本题主要考查了氨气的催化氧化,解答须掌握该反应的原理和相关物质的性质,题目难度中等.

练习册系列答案
 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目