题目内容
14.如表各组关于强电解质、弱电解质、非电解质的归类正确的( )| A | B | C | D | |
| 强电解质 | C | NaCl | CaCO3 | HNO3 |
| 弱电解质 | CH3COOH | NH3 | HCl | H2O |
| 非电解质 | 蔗糖 | BaSO4 | C2H5OH | 酒精 |
| A. | A | B. | B | C. | C | D. | D |
分析 强电解质是水溶液中或熔融状态下完全电离的电解质;
弱电解质是水溶液中不能完全电离的电解质;
非电解质是指在水溶液和熔化状态下都不能导电的化合物,据此解答.
解答 解:A.石墨属于金属单质,既不是电解质,又不是非电解质,故A错误;
B.氯化钠在水溶液中和熔融状态下均能完全电离,故为强电解质;NH3本身不能电离,属于非电解质;BaSO4为盐,在熔融状态下能够导电,属于电解质,故B错误;
C.CaCO3属于盐,熔融状态下完全电离,属于强电解质;HCl在水溶液中完全电离,属于强电解质;乙醇在水溶液和熔化状态下都不能导电,属于非电解质,故C错误;
D.HNO3在水溶液中能完全电离,故为强电解质;H2O能部分电离出氢离子和氢氧根,故为弱电解质;酒精为非电解质,故D正确;
故选D.
点评 本题考查了强电解质和弱电解质的概念分析应用,明确物质性质和类别是解题关键,注意单质、混合物既不是电解质又不是非电解质,题目难度不大.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
4.下列说法中正确的是( )
| A. | 能溶于水的盐是强电解质,不溶于水的盐是非电解质 | |
| B. | 强电解质溶液中不存在分子,弱电解质溶液中必存在溶质分子 | |
| C. | 在熔融状态下能导电的化合物一定是离子化合物,也一定是强电解质 | |
| D. | 强电解质一定能导电,非电解质的水溶液一定不导电 |
5.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 常温常压下,6.4g O2和O3的混合气体中含有的原子数为0.4NA | |
| B. | 在反应中消耗0.1molCl2,转移的电子数一定为0.2NA | |
| C. | 含2mol H2SO4的浓硫酸与足量铜粉完全反应,生成气体分子的数目为2NA | |
| D. | 标准状况下,11.2L CCl4中含有的分子数目为0.5NA |
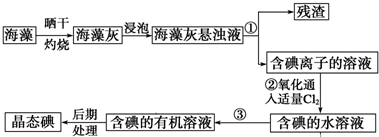
2.通过火法冶金炼出的铜是粗铜,含有Zn、Fe、Ag、Au等杂质.在实验室条件下用CuSO4溶液作电解液进行电解精炼,并对电解废液进行综合处理.
(1)电解精炼铜时粗铜板作阳极,阴极电极反应式为Cu2++2e-═Cu.电解过程中,电解液中c(Cu2+)变小(填变大、变小、不变).对电解废液进行如下处理
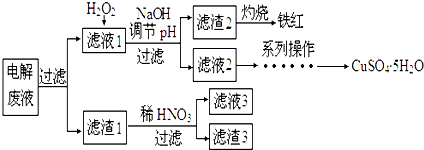
已知:①某些金属离子形成氢氧化物沉淀的pH如表
②Zn(OH)2+2NaOH=Na2ZnO2+2H2O
(2)滤液l中加入H2O2发生反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)加NaOH溶液调节溶液pH的范围是3.2≤pH<4.7.
(4)滤渣1跟稀HNO3反应的化学方程式是3Ag+4HNO3═3AgNO3+NO↑+2H2O.
(1)电解精炼铜时粗铜板作阳极,阴极电极反应式为Cu2++2e-═Cu.电解过程中,电解液中c(Cu2+)变小(填变大、变小、不变).对电解废液进行如下处理

已知:①某些金属离子形成氢氧化物沉淀的pH如表
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀 | 2.3 | 7.5 | 4.7 | 5.4 |
| 完全沉淀 | 3.2 | 9.7 | 6.7 | 8.0 |
(2)滤液l中加入H2O2发生反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)加NaOH溶液调节溶液pH的范围是3.2≤pH<4.7.
(4)滤渣1跟稀HNO3反应的化学方程式是3Ag+4HNO3═3AgNO3+NO↑+2H2O.
19.下列说法中正确的是( )
| A. | 在BF3、NaCl3分子中,所有原子都满足8电子稳定机构 | |
| B. | P4和CH4空间结构相同,其具有的化学键类型也完全相同 | |
| C. | Cl-的结构示意图可表示为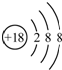 | |
| D. | COS的电子式可表示为 |
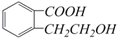 ,它可以通过不同的反应得到下列物质:
,它可以通过不同的反应得到下列物质: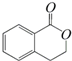 C.
C. D.
D.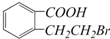
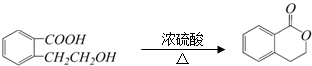 +H2O.
+H2O. 已知A、B、C为常见单质,在一定条件下可发生如下转化(反应条件及部分反应物和生成物已省略):
已知A、B、C为常见单质,在一定条件下可发生如下转化(反应条件及部分反应物和生成物已省略):