题目内容
下列各组粒子,按半径由大到小顺序排列的是( )?
| A.Mg、Ca、K、Na? |
| B.S2-、Cl-、K+、Na+? |
| C.Br-、Br、Cl、S? |
| D.Na+、Al3+、Cl-、F-? |
B
A选项中,K、Ca比Na、Mg多1个电子层,故有:r(K)>r(Ca)>r(Na)>r(Mg)。
B选项中,S2-、Cl-、K+三离子核外电子排布相同,核电荷数越小,离子半径越大;又K+比Na+多1个电子层,故有:r(S2-)>r(Cl-)>r(K+)>r(Na+)。
C选项中,Br-比Br价态低,价态越低半径越大;Br比Cl多1个电子层,Br半径大,Cl、S电子层数相同,但S核电荷数小,半径大。故有:r(Br-)> r(Br)>r(Cl)<r(S)。
D选项中,Na+、Al3+、F-核外电子排布相同,核电荷数越小原子半径越大;Cl-比F-多1个电子层。故有:r(Cl-)>r(F-)>r(Na+)>r(Al3+)。
B选项中,S2-、Cl-、K+三离子核外电子排布相同,核电荷数越小,离子半径越大;又K+比Na+多1个电子层,故有:r(S2-)>r(Cl-)>r(K+)>r(Na+)。
C选项中,Br-比Br价态低,价态越低半径越大;Br比Cl多1个电子层,Br半径大,Cl、S电子层数相同,但S核电荷数小,半径大。故有:r(Br-)> r(Br)>r(Cl)<r(S)。
D选项中,Na+、Al3+、F-核外电子排布相同,核电荷数越小原子半径越大;Cl-比F-多1个电子层。故有:r(Cl-)>r(F-)>r(Na+)>r(Al3+)。

练习册系列答案
相关题目
 Mg(g) ΔH1="141" kJ·mol-1
Mg(g) ΔH1="141" kJ·mol-1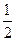 O2
O2