题目内容
Ⅰ.氨气是氮循环中的重要物质,在人类的生产和生活中有着广泛的应用.根据所学知识,据此完成下列要求.
(1)如图是N2与H2反应过程中能量变化的示意图,写出该反应生成液态氨的热化学方程式为______.
(2)若由N2和H2合成1molNH3时可放出46.2kJ/mol的热量.从手册上查出N≡N键的键能是948.9kJ/mol,H-H键的键能是436.0kJ/mol,则N-H键的键能是______kJ/mol.
Ⅱ.已知25℃、101kpa时,一些物质的燃烧热为:
(1)写出该条件下CH3OH(l)完全燃烧的热化学方程式:______.
(2)根据盖斯定律完成下列反应的热化学方程式:
CO(g)+2H2(g)═CH3OH(l)△H=______.
(3)现有H2和CH4的混合气体112L(标准状况),使其完全燃烧生成CO2(g)和H2O(l),共放出热量3242.5kJ,则原混合气体中H2和CH4的物质的量之比是______.
A.1:1B.1:3C.1:4D.2:3.
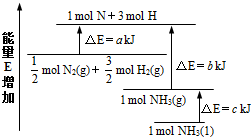
(1)如图是N2与H2反应过程中能量变化的示意图,写出该反应生成液态氨的热化学方程式为______.
(2)若由N2和H2合成1molNH3时可放出46.2kJ/mol的热量.从手册上查出N≡N键的键能是948.9kJ/mol,H-H键的键能是436.0kJ/mol,则N-H键的键能是______kJ/mol.
Ⅱ.已知25℃、101kpa时,一些物质的燃烧热为:
| 化学式 | CO(g) | H2(g) | CH3OH(l) | CH4(g) |
| △H/(kJ/mol) | -283.0 | -285.8 | -726.5 | -890.3 |
(2)根据盖斯定律完成下列反应的热化学方程式:
CO(g)+2H2(g)═CH3OH(l)△H=______.
(3)现有H2和CH4的混合气体112L(标准状况),使其完全燃烧生成CO2(g)和H2O(l),共放出热量3242.5kJ,则原混合气体中H2和CH4的物质的量之比是______.
A.1:1B.1:3C.1:4D.2:3.

I(1)由图可以看出,断裂
molN2(g)和
molH2(g)的吸收能量为akJ,形成1molNH3(g)的所放出的能量为bkJ,
所以,
molN2(g)+
molH2(g)?NH3(g)△H=(a-b)kJ/mol,
而1mol的NH3(g)转化为1mol的NH3(l)放出的热量为ckJ,
所以有:
molN2(g)+
molH2(g)?NH3(l)△H=(a-b-c)kJ/mol,
即:N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ?mol-1,
故答案为:N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ?mol-1;
(2)N2和H2合成NH3的方程式为:N2+3H2 2NH3,由N2和H2合成1molNH3时可放出46.2kJ/mol的热量,则反应的△H=-2×46.2=-92.4kJ/mol,
2NH3,由N2和H2合成1molNH3时可放出46.2kJ/mol的热量,则反应的△H=-2×46.2=-92.4kJ/mol,
1molN2和3molH2反应断裂化学键需要吸收的能量为:1mol×948.9kJ?mol-1+3×436.0kJ?mol-1=2256.9kJ,
N-H键的键能为x,形成2molNH3需要形成6molN-H键,则形成6molN-H键放出的能量为6x,
则2256.9-6×x=-92.4kJ/mol,解得x=391.55kJ/mol,
故答案为:391.55;
II(1)1mol甲醇完全燃烧生成二氧化碳和液态水放热726.5KJ;燃烧热的热化学方程式为:CH3OH(l)+
O2(g)═CO2(g)+2H2O(l)△H=-726.5kJ?mol-1,
故答案为:CH3OH(l)+
O2(g)═CO2(g)+2H2O(l)△H=-726.5 kJ?mol-1;
(2)依据题干写出物质的燃烧热化学方程式:①CH3OH(l)+
O2(g)=CO2(g)+2H2O(l);△=-726.5KL/mol;
②CO(g)+
O2(g)=CO2(g)△H=-283KJ/mol;
③H2(g)+
O2(g)=H2O(l)△H=-285.5KJ/mol;
依据盖斯定律③×2+②-①得到:CO(g)+2H2(g)=CH3OH(l)△H=-128.1KJ/mol;
故答案为:-128.1KJ/mol;
(3)有H2和CH4的混合气体112L(标准状况)物质的量=
=5mol,使其完全燃烧生成CO2(g)和H2O(l),共放出热量3242.5kJ,设H2物质的量为X、CH4物质的量为5-X;依据热化学方程式列式计算:
H2(g)+
O2(g)=H2O(l)△H=-285.5KJ/mol;
1 285.5KJ
X 285.5XKJ
CH4(g)+2O2(g)=CO2(g)+H2O(l)△H=-890.3KJ/mol;
1 890.3KJ
5-X (5-X)×890.3KJ
285.5XKJ+(5-X)×890.3KJ=3242.5kJ
解得到:X=2mol,甲烷物质的量为3mol
则原混合气体中H2和CH4的物质的量之比是2:3;
故答案为:D.
| 1 |
| 2 |
| 3 |
| 2 |
所以,
| 1 |
| 2 |
| 3 |
| 2 |
而1mol的NH3(g)转化为1mol的NH3(l)放出的热量为ckJ,
所以有:
| 1 |
| 2 |
| 3 |
| 2 |
即:N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ?mol-1,
故答案为:N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ?mol-1;
(2)N2和H2合成NH3的方程式为:N2+3H2
 2NH3,由N2和H2合成1molNH3时可放出46.2kJ/mol的热量,则反应的△H=-2×46.2=-92.4kJ/mol,
2NH3,由N2和H2合成1molNH3时可放出46.2kJ/mol的热量,则反应的△H=-2×46.2=-92.4kJ/mol,1molN2和3molH2反应断裂化学键需要吸收的能量为:1mol×948.9kJ?mol-1+3×436.0kJ?mol-1=2256.9kJ,
N-H键的键能为x,形成2molNH3需要形成6molN-H键,则形成6molN-H键放出的能量为6x,
则2256.9-6×x=-92.4kJ/mol,解得x=391.55kJ/mol,
故答案为:391.55;
II(1)1mol甲醇完全燃烧生成二氧化碳和液态水放热726.5KJ;燃烧热的热化学方程式为:CH3OH(l)+
| 3 |
| 2 |
故答案为:CH3OH(l)+
| 3 |
| 2 |
(2)依据题干写出物质的燃烧热化学方程式:①CH3OH(l)+
| 3 |
| 2 |
②CO(g)+
| 1 |
| 2 |
③H2(g)+
| 1 |
| 2 |
依据盖斯定律③×2+②-①得到:CO(g)+2H2(g)=CH3OH(l)△H=-128.1KJ/mol;
故答案为:-128.1KJ/mol;
(3)有H2和CH4的混合气体112L(标准状况)物质的量=
| 112L |
| 22.4L/mol |
H2(g)+
| 1 |
| 2 |
1 285.5KJ
X 285.5XKJ
CH4(g)+2O2(g)=CO2(g)+H2O(l)△H=-890.3KJ/mol;
1 890.3KJ
5-X (5-X)×890.3KJ
285.5XKJ+(5-X)×890.3KJ=3242.5kJ
解得到:X=2mol,甲烷物质的量为3mol
则原混合气体中H2和CH4的物质的量之比是2:3;
故答案为:D.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目