题目内容
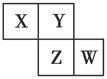
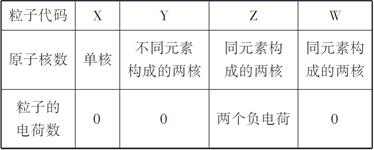
有X、Y、Z、W四种含14个电子的粒子,其结构特点如下:
(1)A原子核外比X原子多3个电子,A的原子结构示意图是________;含1 mol X的氧化物晶体中含有共价键数目为________。
(2)Z与钙离子组成的化合物的电子式为________________。
(3)14 g Y完全燃烧放出的热量是141.5 kJ,写出Y燃烧的热化学方程式:______________________________。
(4)组成W的元素最高价氧化物对应的水化物甲有下图所示转化关系(反应条件和其他物质已略):
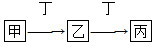
①写出丁在高温下与水反应的化学方程式:__________________;
②组成W的元素的简单氢化物极易溶于水的主要原因是________________________
该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH,其负极的电极反应式为____________。

(1)A原子核外比X原子多3个电子,A的原子结构示意图是________;含1 mol X的氧化物晶体中含有共价键数目为________。
(2)Z与钙离子组成的化合物的电子式为________________。
(3)14 g Y完全燃烧放出的热量是141.5 kJ,写出Y燃烧的热化学方程式:______________________________。
(4)组成W的元素最高价氧化物对应的水化物甲有下图所示转化关系(反应条件和其他物质已略):

①写出丁在高温下与水反应的化学方程式:__________________;
②组成W的元素的简单氢化物极易溶于水的主要原因是________________________
该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH,其负极的电极反应式为____________。
(1) 4NA(或2.408×1024)
4NA(或2.408×1024)
(2)Ca2+[:C??C:]2-
(3)2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
(4)①3Fe+4H2O Fe3O4+4H2
Fe3O4+4H2
②NH3与H2O间能形成氢键
2NH3-6e-+6OH-=N2+6H2O
 4NA(或2.408×1024)
4NA(或2.408×1024)(2)Ca2+[:C??C:]2-
(3)2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
(4)①3Fe+4H2O
 Fe3O4+4H2
Fe3O4+4H2②NH3与H2O间能形成氢键
2NH3-6e-+6OH-=N2+6H2O
由表格可推知:X是Si,Y是CO,Z是C22—,W是N2。(1)比Si原子核外电子数多3的原子是Cl; SiO2是原子晶体,每个Si与4个O相连,所以1 mol SiO2中含有4 mol Si-O键。(2)C22—与Ca形成离子化合物CaC2,C22—中两个碳原子之间形成碳碳三键。(3)14 g CO是0.5 mol,放出热量141.5 kJ,故CO完全燃烧放出热量566 kJ。(4)由题意可推知:甲是HNO3,乙是Fe(NO3)3,丙是Fe(NO3)2,丁是Fe。①Fe和水蒸气在高温条件下生成Fe3O4和H2。②NH3与H2O分子间能形成氢键而导致NH3极易溶于水;由燃料电池反应原理知:该电池反应的反应物有NH3、O2和KOH,负极失去电子发生氧化反应,所以负极的反应物是NH3,在碱性条件下生成N2和H2O。
点拨:本题考查物质的推导、化学反应原理,考查考生知识的应用能力。难度较大。
点拨:本题考查物质的推导、化学反应原理,考查考生知识的应用能力。难度较大。

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案
相关题目

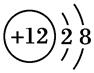 ,下列说法正确的是( )
,下列说法正确的是( )