题目内容
18.下列说法正确的是( )| A. | 电解稀硫酸或氢氧化钠溶液的产物不同 | |
| B. | 常温下,pH=6的溶液一定是酸溶液 | |
| C. | c(H+)>c(OH-)的溶液一定显酸性 | |
| D. | 水电解生成氢气和氧气,证明水是弱电解质 |
分析 A.电解稀硫酸或氢氧化钠溶液,实质均为电解水;
B.常温下,中性溶液的pH=7,显酸性的溶液不一定为酸溶液;
C.利用c(H+)、c(OH-)的相对大小判断溶液的酸碱性;
D.水的电解与弱电解质不存在关系.
解答 解:A.电解稀硫酸或氢氧化钠溶液,实质均为电解水,电解产物均为氢气、氧气,电解产物相同,故A错误;
B.常温下,中性溶液的pH=7,显酸性的溶液不一定为酸溶液,如硫酸氢钠溶液的pH=6,为盐溶液,故B错误;
C.由c(H+)、c(OH-)的相对大小可知溶液的酸碱性,c(H+)>c(OH-)的溶液一定显酸性,故C正确;
D.水的电解与弱电解质不存在关系,不能利用电解判断水为弱电解质,分析角度不合理,故D错误;
故选C.
点评 本题考查较综合,涉及电解、溶液酸碱性、弱电解质等,把握相关反应原理及相关概念为解答的关键,侧重分析与应用能力的考查,注意化学反应原理的应用,题目难度不大.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
8.下列有关物质用途的说法中,不正确的是( )
| A. | 干冰可用作致冷剂 | B. | 在铁制容器表面刷铝粉可防止生锈 | ||
| C. | 氢氧化钠可用作医用胃酸中和剂 | D. | 过氧化钠可用作供氧剂 |
9.若40g密度为P g•Cm-3cm的硝酸钙溶液里含1g Ca2+,则NO3-的物质的量浓度是( )
| A. | p/400 mol•L-1 | B. | 20 p mol•L-1 | C. | 1.25 p mol•L-1 | D. | 2.5 p mol••L-1 |
3.以下实验操作正确的是( )
| A. | 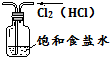 除去Cl2中的HCl气体 | B. |  淡化海水 | ||
| C. | 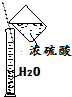 稀释浓硫酸 | D. | 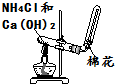 实验室制取氨气 |
10.下列事实能用勒夏特列原理解释的是( )
| A. | 硫酸氢钠溶液的pH值小于7 | |
| B. | 久制的氨水pH值变小 | |
| C. | 合成氨工厂通常采用500℃高温,以提高原料的利用率 | |
| D. | 过氧化氢分解加氯化铁溶液作催化剂,使单位时间内产生的氧气的量多 |
7.在5L的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)×c(H{\;}_{2}O)}{c(CO{\;}_{2})×c({H}_{2})}$.
(2)该反应的△H>(填“>”或“<”)0.
(3)某温度下,该反应平衡时各物质的浓度关系为:3[c(CO2)•c(H2)]=5[c(CO)•c(H2O)],则反应温度是700℃.
(4)将CO2和H2各0.05mol充入该容器中,某温度下达到平衡状态,测得c(CO)=0.008mol/L,则CO2的转化率为80%.
(5)若容器容积不变,温度不变,平衡后向容器内继续充入CO2,则H2的转化率变大,CO2的转化率变小(填“变大”“变小”或“不变”).
(6)该反应达到平衡后,只改变一个条件,平衡向逆反应方向移动的是ad.
a.降低温度 b.保持压强不变,充入N2 c.保持容器容积不变,充入N2 d.保持容器容积不变,加入NaOH溶液.
| t/℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(2)该反应的△H>(填“>”或“<”)0.
(3)某温度下,该反应平衡时各物质的浓度关系为:3[c(CO2)•c(H2)]=5[c(CO)•c(H2O)],则反应温度是700℃.
(4)将CO2和H2各0.05mol充入该容器中,某温度下达到平衡状态,测得c(CO)=0.008mol/L,则CO2的转化率为80%.
(5)若容器容积不变,温度不变,平衡后向容器内继续充入CO2,则H2的转化率变大,CO2的转化率变小(填“变大”“变小”或“不变”).
(6)该反应达到平衡后,只改变一个条件,平衡向逆反应方向移动的是ad.
a.降低温度 b.保持压强不变,充入N2 c.保持容器容积不变,充入N2 d.保持容器容积不变,加入NaOH溶液.
8.下列变化中需要加入还原剂才能实现的是( )
| A. | 亚硫酸钠→二氧化硫 | B. | 氯气→氯离子 | ||
| C. | 硝酸→二氧化氮 | D. | 二氧化硫→硫单质 |