题目内容
【题目】某研究小组为了探究一种抗酸药X(仅含五种短周期元素)的组成和性质,设计并完成了如下实验:
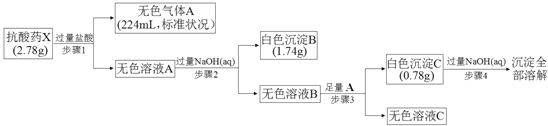
请回答下列问题:
(1)白色沉淀B中金属元素的离子结构示意图为_______,A的电子式为__________.
(2)步骤3中生成沉淀C的离子方程式为______________________________.
(3)X的化学式为______________,该抗酸药不适合胃溃疡重症患者使用,原因是______________________________.
(4)设计实验方案验证溶液C中的含碳酸氢根离子____________________________.
【答案】 )
![]() AlO2﹣+CO2+2H2O=Al(OH)3↓+HCO3﹣ AlMg3(CO3)(OH)7 和胃酸反应生成二氧化碳容易造成胃穿孔 取少量溶液C,先滴入BaCl2溶液,无明显现象,再滴入NaOH溶液,有白色沉淀产生,则溶液C中含有碳酸氢根离子
AlO2﹣+CO2+2H2O=Al(OH)3↓+HCO3﹣ AlMg3(CO3)(OH)7 和胃酸反应生成二氧化碳容易造成胃穿孔 取少量溶液C,先滴入BaCl2溶液,无明显现象,再滴入NaOH溶液,有白色沉淀产生,则溶液C中含有碳酸氢根离子
【解析】根据题给流程和信息确定气体A为CO2,沉淀B为氢氧化镁,沉淀C为氢氧化铝。(1)白色沉淀B为氢氧化镁,镁离子的离子结构示意图为 ,A为二氧化碳,电子式为
,A为二氧化碳,电子式为![]() ;
;
(2)根据题给流程判断无色溶液中含有AlO2﹣,向其中通入足量二氧化碳生成氢氧化铝沉淀和碳酸氢根,离子方程式为AlO2﹣+CO2+2H2O=Al(OH)3↓+HCO3﹣;(3)二氧化碳在标准状况下的体积为224mL,物质的量为0.01mol,则X中含碳酸根的物质的量为0.01mol,质量为0.6g;m[Mg(OH)2]=1.74g,则X中含Mg2+的物质的量为:n(Mg2+)= n[Mg(OH)2]=0.03mol,m(Mg2+)=0.72g;m[Al(OH)3]=0.78g,则X中含Al3+的物质的量为:n(Al3+)= n[Al(OH)3]=0.01mol,m(Al3+)=0.27g;又X为抗酸药,则其中含氢氧根,质量为(2.78-0.6-0.72-0.27)g=1.19g,物质的量为0.07mol,则X的化学式为Mg3Al(OH)7CO3或[2Mg(OH)2·Al(OH)3·MgCO3],该抗酸药不适合胃溃疡重症患者使用,原因是该抗酸药与胃酸反应生成CO2,可能导致胃穿孔;(4)验证步骤3后得到的无色溶液C中含有碳酸氢根离子的实验方案为:取少量溶液C,先滴入BaCl2溶液,无明显现象,再滴入NaOH溶液,有白色沉淀产生,则溶液C中含有HCO3-。