题目内容
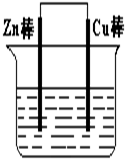 将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如下图所示装置.试回答下列问题:
将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如下图所示装置.试回答下列问题:(1)若电解质溶液为稀硫酸,则Zn棒为原电池的
负
负
极,可观察到Cu棒的所产生现象是有气体析出
有气体析出
,试用电极反应式表示该现象:2H++2e-=H2↑
2H++2e-=H2↑
.(2)若电解质为硫酸铜溶液,则Cu棒上发生
还原
还原
反应,Zn棒上发生反应的电极反应式为:Zn-2e-=Zn2+
Zn-2e-=Zn2+
.(3)若在上述两个过程中,Zn棒减少的质量相等,则Cu棒上(1)和(2)所析出物质的质量之比为:
1:32.
1:32.
.分析:(1)铜锌原电池中,活泼金属作负极,在正极上有气体生成;
(2)若电解质为硫酸铜溶液,则在正极上析出铜;
(3)根据原电池两极上得失电子数目相等计算.
(2)若电解质为硫酸铜溶液,则在正极上析出铜;
(3)根据原电池两极上得失电子数目相等计算.
解答:解:(1)将Zn棒和Cu棒用导线连接后,若电解质溶液为稀硫酸,则锌为负极,铜为正极,负极反应为:Zn-2e-=Zn2+,
正极反应为:2H++2e-=H2↑,在正极上有气体生成.故答案为:负,有气体析出,2H++2e-=H2↑;
(2)将Zn棒和Cu棒用导线连接后,若电解质为硫酸铜溶液,则在正极上析出铜,锌为负极,负极反应为Zn-2e-=Zn2+,
正极反应为:Cu2++2e-=Cu,
故答案为:还原,Zn-2e-=Zn2+;
(3)设上述两个过程中都消耗1molZn,则:Cu棒上(1)所析出物质的质量为:1mol×2g/mol=2g,
(2)所析出物质的质量为:1mol×64g/mol=64g,Cu棒上(1)和(2)所析出物质的质量之比为2g:64g=1:32.
故答案为:1:32.
正极反应为:2H++2e-=H2↑,在正极上有气体生成.故答案为:负,有气体析出,2H++2e-=H2↑;
(2)将Zn棒和Cu棒用导线连接后,若电解质为硫酸铜溶液,则在正极上析出铜,锌为负极,负极反应为Zn-2e-=Zn2+,
正极反应为:Cu2++2e-=Cu,
故答案为:还原,Zn-2e-=Zn2+;
(3)设上述两个过程中都消耗1molZn,则:Cu棒上(1)所析出物质的质量为:1mol×2g/mol=2g,
(2)所析出物质的质量为:1mol×64g/mol=64g,Cu棒上(1)和(2)所析出物质的质量之比为2g:64g=1:32.
故答案为:1:32.
点评:本题考查原电池的工作原理,题目难度不大,注意电极的判断和电解反应式的书写.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
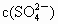 逐渐增大
逐渐增大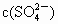 逐渐增大
逐渐增大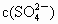 基本不变
基本不变 逐渐增大
逐渐增大 逐渐增大
逐渐增大 基本不变
基本不变