题目内容
某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或二种。现将13.8 g样品加入足量水,样品全部溶解。再加入过量的CaCl2溶液,得到9 g沉淀。对样品所含杂质的正确判断是
| A.肯定有KNO3 |
| B.肯定有KNO3,可能还含有Na2CO3 |
| C.肯定没有Ba(NO3)2,可能有KNO3 |
| D.肯定没有Na2CO3和Ba(NO3)2 |
AB
将13.8 g样品加入足量的水,样品全溶解则样品中一定无Ba(NO3)2(因能与K2CO3生成沉淀)。下面用中值法分析:如13.8 g是纯的K2CO3,则生成CaCO3沉淀应为10 g,而现在得沉淀9 g,则混进的杂质或不与CaCl2生成沉淀,或13.8 g杂质与CaCl2作用生成的沉淀小于9 g。杂质中KNO3不与CaCl2生成沉淀,符合题意。而13.8 g Na2CO3与CaCl2混合生成沉淀为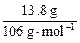 ×100 g·mol-1>9 g不合理。所以选项A正确。但分析选项B,可能存在这样的情况,即混进很多的KNO3,而只混进少量的Na2CO3,这时也可以保证13.8 g样品与CaCl2反应后只生成9 g沉淀,故B也正确。此题考查学生思维的严密性。选项B很容易漏掉。
×100 g·mol-1>9 g不合理。所以选项A正确。但分析选项B,可能存在这样的情况,即混进很多的KNO3,而只混进少量的Na2CO3,这时也可以保证13.8 g样品与CaCl2反应后只生成9 g沉淀,故B也正确。此题考查学生思维的严密性。选项B很容易漏掉。
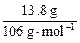 ×100 g·mol-1>9 g不合理。所以选项A正确。但分析选项B,可能存在这样的情况,即混进很多的KNO3,而只混进少量的Na2CO3,这时也可以保证13.8 g样品与CaCl2反应后只生成9 g沉淀,故B也正确。此题考查学生思维的严密性。选项B很容易漏掉。
×100 g·mol-1>9 g不合理。所以选项A正确。但分析选项B,可能存在这样的情况,即混进很多的KNO3,而只混进少量的Na2CO3,这时也可以保证13.8 g样品与CaCl2反应后只生成9 g沉淀,故B也正确。此题考查学生思维的严密性。选项B很容易漏掉。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
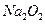 ,放出
,放出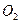 ,充分反应后固体的质量增加2.28 g,试通过计算判断气体 A的组成及各成分的质量。
,充分反应后固体的质量增加2.28 g,试通过计算判断气体 A的组成及各成分的质量。
 回答下列问题:
回答下列问题: