题目内容
一定条件下反应A2(g)+B2(g) 2AB(g)达到平衡状态的标志是 ( )
2AB(g)达到平衡状态的标志是 ( )
A.2υ(正、A2)=υ(逆、AB)
B.容器内的总压强不随时间而变化
C.单位时间内生成n mol AB的同时,生成n mol的B2
D.A2、B2、AB的反应速率比为2:2:1的状态
A
解析试题分析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。A中反应速率的方向相反,且满足反应速率之比是相应的化学计量数之比,可以说明反应达到平衡状态;该反应是体积不变的可逆反应,所以容器内气体的压强始终是不变的,B不正确;C中反应速率的方向相同,速率之比是相应的化学计量数之比,因此C中的关系始终是成立,不正确。平衡时各种物质的浓度不再发生变化,但各种的浓度之间不一定满足某种关系,D不能说明,答案选A。
考点:考查可逆反应平衡状态的判断
点评:该题是中等难度的试题,也是高考中的常见题型和考点。试题基础性强,难易适中,侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生的逻辑推理能力和发散思维能力。该题的关键是明确平衡状态的特点,然后结合具体的可逆反应灵活运用即可。

对化学反应限度的叙述,错误的是
| A.任何可逆反应都有一定的限度 |
| B.化学反应达到限度时,正逆反应速率相等 |
| C.化学反应的限度与时间的长短无关 |
| D.化学反应的限度是不可改变的 |
下列关于判断过程的方向的说法正确的是 ( )
| A.所有自发进行的化学反应都是放热反应 |
| B.高温高压下可以使石墨转化为金刚石是自发的化学反应 |
| C.由能量判据和熵判据组合而成的复合判据,将更适合于所有的过程 |
| D.同一物质的固、液、气三种状态的熵值相同 |
乙酸蒸气能形成二聚分子: 2CH3COOH(气) (CH3COOH)2(气)+热。现欲测定乙酸的分子量,应采用的反应条件是( )
(CH3COOH)2(气)+热。现欲测定乙酸的分子量,应采用的反应条件是( )
| A.低温高压 | B.高温低压 | C.低温低压 | D.高温高压 |
在

 的可逆反应中,自反应开始至2 s末,氨的浓度由0变为0.4
的可逆反应中,自反应开始至2 s末,氨的浓度由0变为0.4 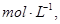 则以氢气的浓度变化表示该反应在2 s内的平均反应速率是
则以氢气的浓度变化表示该反应在2 s内的平均反应速率是
A.0.3 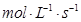 | B.0.4 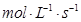 |
C.0.6 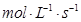 | D.0.8 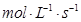 |
(16分)I.将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,各物质浓度随时间变化的关系如图1所示。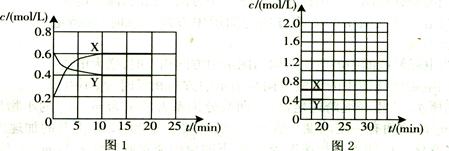
请回答:
(1)下列选项中不能说明该反应已达到平衡状态的是 (填选项字母)。
| A.容器内混合气体的压强不随时间变化而改变 |
| B.容器内混合气体的密度不随时间变化而改变 |
| C.容器内混合气体的颜色不随时间变化而改变 |
| D.容器内混合气体的平均相对分子质量不随时间变化而改变 |
;
(3)计算该反应的平衡常数K= 。
(4)反应进行到20 min时,再向容器内充入一定量NO2,10min后达到新的平衡,此
时测得c(NO2)="0.9" mol/L。
第一次平衡时混合气体中NO2的体积分数为w1,达到新平衡后混合气体中NO2的体积分数为w2,则w1 w2 (填“>”、“=”或“<”);
请在图2中画出20 min后各物质的浓度随时间变化的曲线(曲线上必须标出“X”和
“Y”)。
II.(1)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学
电源的重要原料。如LiFePO4电池中某电极的工作原理如下图所示:
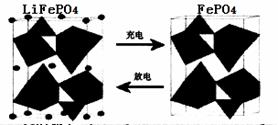
该电池的电解质为能传导Li+的固体材料。放电时该电极是电池的 极(填“正”或“负”),该电极反应式为 。
(2)用此电池电解含有0.1 mol/L CuSO4和0.1 mol/L NaCl的混合溶液100 mL,假如电路中转移了0.02 mol e-,且电解池的电极均为惰性电极,阳极产生的气体在标准状况下的体积是__________L.
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)硫酸铜溶液可以加快氢气生成速率的原因是________________
(2)实验室中现有Na2SO4、CuCl2、MgSO4、K2SO4等4种溶液,可与上述实验中CuSO4
溶液起相似作用的是________;
(3)要加快上述实验中气体产生的速率,还可采取的措施有________________(答两种)
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,
收集产生的气体,记录获得相同体积的气体所需时间。
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol/L H2SO 4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液 /mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O /mL | V7 | V8 | V9 | V10 | 10 | 0 |
② 该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因
对下列图像的描述正确的是( )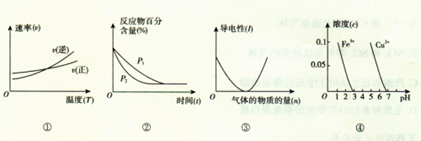
A.根据图①可判断反应A2(g)+3B2(g)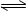 2AB3(g)的△H>0 2AB3(g)的△H>0 |
B.图②可表示压强(P)对反应2A(g)+2B(g)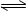 3C(g)+D(s)的影响 3C(g)+D(s)的影响 |
| C.图③可表示向醋酸溶液通人氨气时,溶液导电性随氨气量的变化 |
| D.根据图④,除去CuSO4溶液中的Fe3+,可加入CuO调节pH至3~5 |
