题目内容
高锰酸钾是深紫色的针状晶体,是常用的氧化剂之一.
Ⅰ.实验室可用软锰矿(主要成分是 MnO2)为原料制备高锰酸钾,基本过程如下:
(l)将软锰矿与 KOH 的混合物放入铁增祸内,混合均匀,小火加热,并用铁棒搅拌,使混合物熔融,即可得绿色的KMnO4.反应的化学方程式为2MnO2+4KOH+O2═2K2MnO4+2H2O.实验中,不能将铁棒改为玻璃棒,理由是 .
(2)将 K2MnO4溶于水,通入CO2气体发生反应可制得 KMnO4,同时产生了黑色沉淀.该反应的化学方程式为 .
Ⅱ.鉴于Ⅰ中原料的利用率较低,通常使用如下流程,用镍片做阳极,铁板为阴极,电解K2MnO4溶液来制备KMnO4.
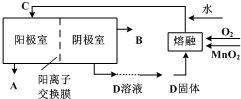
据图回答以下问题:
(3)B的化学式为 .
(4)阳极的电极反应式为 .
(5)从合理利用能源的角度,该制备流程可作相应改进,你的改进措施是 .
Ⅰ.实验室可用软锰矿(主要成分是 MnO2)为原料制备高锰酸钾,基本过程如下:
(l)将软锰矿与 KOH 的混合物放入铁增祸内,混合均匀,小火加热,并用铁棒搅拌,使混合物熔融,即可得绿色的KMnO4.反应的化学方程式为2MnO2+4KOH+O2═2K2MnO4+2H2O.实验中,不能将铁棒改为玻璃棒,理由是
(2)将 K2MnO4溶于水,通入CO2气体发生反应可制得 KMnO4,同时产生了黑色沉淀.该反应的化学方程式为
Ⅱ.鉴于Ⅰ中原料的利用率较低,通常使用如下流程,用镍片做阳极,铁板为阴极,电解K2MnO4溶液来制备KMnO4.

据图回答以下问题:
(3)B的化学式为
(4)阳极的电极反应式为
(5)从合理利用能源的角度,该制备流程可作相应改进,你的改进措施是
分析:Ⅰ、(1)玻璃棒的成分中有二氧化硅,二氧化硅能和氢氧化钾反应;
(2)黑色沉淀为MnO2;
Ⅱ、(3)电解锰酸钾溶液时,阴极上水得电子生成氢气和氢氧根离子,电极反应为2H2O+2e-═H2↑+2OH-,所以B气体为H2;
(4)在电解槽中用铂板作用阳极,铁作阴极电解K2MnO4溶液得到KMnO4,阴极上水得电子发生还原反应生成氢气和氢氧根离子,阳极上锰酸根离子失电子反应氧化反应生成高锰酸根离子;
(5)流程中为合理利用能源,可以利用氢气做燃料提供热能;
(2)黑色沉淀为MnO2;
Ⅱ、(3)电解锰酸钾溶液时,阴极上水得电子生成氢气和氢氧根离子,电极反应为2H2O+2e-═H2↑+2OH-,所以B气体为H2;
(4)在电解槽中用铂板作用阳极,铁作阴极电解K2MnO4溶液得到KMnO4,阴极上水得电子发生还原反应生成氢气和氢氧根离子,阳极上锰酸根离子失电子反应氧化反应生成高锰酸根离子;
(5)流程中为合理利用能源,可以利用氢气做燃料提供热能;
解答:解:Ⅰ、(1)二氧化硅能和氢氧化钾反应,反应方程式为:2KOH+SiO2═K2SiO3+H2O,
故答案为:高温下KOH会腐蚀玻璃并带进硅酸盐等杂质;
(2)将K2MnO4溶于水,通入CO2气体发生反应可制得KMnO4,同时产生了黑色沉淀,根据信息,锰的化合价从+6价,升高为+7,根据氧化还原反应规律,必有元素化合价降低,从反应物的性质知,只有锰自身的氧化还原,即化合价降低,降为相邻的价态+4价,符合题目中的黑色沉淀信息特征,该反应为3K2MnO4+2CO2═2KMnO4+MnO2↓+2K2CO3,
故答案为:3K2MnO4+2CO2═2KMnO4+MnO2↓+2K2CO3;
Ⅱ、(3)电解锰酸钾溶液时,阴极上水得电子生成氢气和氢氧根离子,电极反应为2H2O+2e-═H2↑+2OH-,所以B气体为H2,
故答案为:H2;
(4)电解锰酸钾溶液时,阴极上水得电子生成氢气和氢氧根离子,电极反应为2H2O+2e-═H2↑+2OH-,阳极上锰酸根离子失电子生成高锰酸根离子,电极反应式为2MnO42--2e-═2MnO4-,
故答案为:2MnO42--2e-═2MnO4-;
(5)从合理利用能源的角度,该制备流程可作相应改进,将电解池阴极产生的氢气作为燃料为熔融软锰矿、氢氧化钾提供热源,
故答案为:将电解池阴极产生的氢气作为燃料为熔融软锰矿、氢氧化钾提供热源.
故答案为:高温下KOH会腐蚀玻璃并带进硅酸盐等杂质;
(2)将K2MnO4溶于水,通入CO2气体发生反应可制得KMnO4,同时产生了黑色沉淀,根据信息,锰的化合价从+6价,升高为+7,根据氧化还原反应规律,必有元素化合价降低,从反应物的性质知,只有锰自身的氧化还原,即化合价降低,降为相邻的价态+4价,符合题目中的黑色沉淀信息特征,该反应为3K2MnO4+2CO2═2KMnO4+MnO2↓+2K2CO3,
故答案为:3K2MnO4+2CO2═2KMnO4+MnO2↓+2K2CO3;
Ⅱ、(3)电解锰酸钾溶液时,阴极上水得电子生成氢气和氢氧根离子,电极反应为2H2O+2e-═H2↑+2OH-,所以B气体为H2,
故答案为:H2;
(4)电解锰酸钾溶液时,阴极上水得电子生成氢气和氢氧根离子,电极反应为2H2O+2e-═H2↑+2OH-,阳极上锰酸根离子失电子生成高锰酸根离子,电极反应式为2MnO42--2e-═2MnO4-,
故答案为:2MnO42--2e-═2MnO4-;
(5)从合理利用能源的角度,该制备流程可作相应改进,将电解池阴极产生的氢气作为燃料为熔融软锰矿、氢氧化钾提供热源,
故答案为:将电解池阴极产生的氢气作为燃料为熔融软锰矿、氢氧化钾提供热源.
点评:本题考查了反应流程的分析判断,题干信息的利用,电解池的原理分析,电极反应书写,掌握理论实质是解题关键,题目难度中等.

练习册系列答案
 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
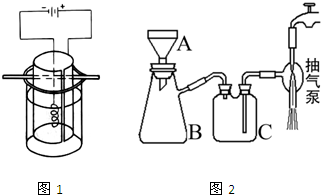 高锰酸钾是深紫色的针状晶体,是最常用的氧化剂之一,工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾.下面是实验室制取高锰酸钾的过程:
高锰酸钾是深紫色的针状晶体,是最常用的氧化剂之一,工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾.下面是实验室制取高锰酸钾的过程:


