题目内容
某化学小组在常温下测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
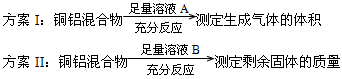
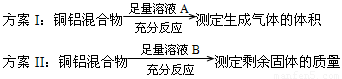
方案Ⅰ: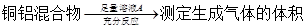
方案Ⅱ: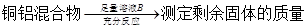
下列有关判断中不正确的是
A.溶液A和B均可以是盐酸或NaOH溶液
B.溶液A和B均可以选用稀硝酸
C.若溶液B选用浓硝酸,则测得铜的质量分数偏小
D.实验室方案II更便于实施
【答案】
B
【解析】
试题分析:溶液A若为盐酸或NaOH,生成的气体为氢气。溶液B若为盐酸或NaOH,剩余固体为铜,A正确;溶液A若选用稀硝酸,生成气体为NO。溶液B若选用稀硝酸,则无固体剩余,B错误;若溶液B选用浓硝酸,铜与浓硝酸反应,铝遇浓硝酸发生钝化,剩余固体质量偏大,铜质量分数偏小,C正确;气体的体积与气体的温度、压强有关,而且测量气体的体积操作不太方便、误差较大。测定剩余固体的质量可通过过滤、洗涤、干燥、晾干即可,操作方便,误差较小,D正确。
考点:化学实验
点评:铝既能与盐酸又能与氢氧化钠溶液反应;常温时,铝、铁遇浓硝酸、浓硫酸发生钝化,铝、铁的表面被氧化生成致密的氧化物保护膜。

练习册系列答案
相关题目
某化学小组在常温下测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案Ⅰ: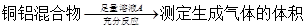
方案Ⅱ: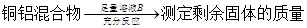
下列有关判断中不正确的是
| A.溶液A和B均可以是盐酸或NaOH溶液 |
| B.溶液A和B均可以选用稀硝酸 |
| C.若溶液B选用浓硝酸,则测得铜的质量分数偏小 |
| D.实验室方案II更便于实施 |