题目内容
氯气和二氧化氮气体在室温下可以化合成一种新的气态化合物A.为了测定A的组成进行以下实验,取Cl2和NO2的混合气体5L,测定反应后气体的总体积随Cl2在原气体中所占体积分数为0.2或0.6时总体积均为4L.
(1)通过分析求A的化学式,写出反应的化学方程式.
(2)试讨论当氯气体积分数x取值不同时,反应总体积V随x变化的函数关系.
答案:
解析:
解析:
|
(1)①x=0.2时, ②x=0.6时, 而上述两种情况下反应后气体总体积相等,所以1L Cl2和2L NO2恰好反应生成2L A,第一种情况NO2过量2L,第二种情况Cl2过量2L.由阿伏加德罗定律知A为ClNO2(NClO2).反应式为Cl2+2NO2 (2)V(Cl2)=5x L,V(NO2)=5-5x L. ①Cl2过量 ②NO2量0<x< |

练习册系列答案
相关题目
 ,
, =4L.
=4L.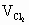 =3L,
=3L, 2ClNO2.
2ClNO2. <x<1,V=5-5x+5x-
<x<1,V=5-5x+5x- (5-5x)=2.5(1+x),
(5-5x)=2.5(1+x),