题目内容
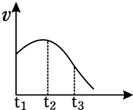 将除去氧化膜的镁条投入到少量稀盐酸中进行实验,实验测得氢气的产生速率变化情况如图曲线所示,对该曲线的解释中正确的是( )
将除去氧化膜的镁条投入到少量稀盐酸中进行实验,实验测得氢气的产生速率变化情况如图曲线所示,对该曲线的解释中正确的是( )分析:镁与盐酸的反应为放热反应,开始反应时,温度不断升高,反应速率不断增大,但随着反应的进行,盐酸浓度逐渐减小,反应速率逐渐减小,以此解答.
解答:解:从t1→t2的原因是镁与酸的反应是放热反应,体系温度升高,反应速率逐渐增大,在盐酸溶液中,镁与氢离子反应,与水不反应,则A正确、B错误;
从t2→t3的原因是盐酸的浓度逐渐降低,反应速率逐渐减小,镁的体积大小不影响反应速率,此时浓度因素大于温度的影响,则C、D错误.
故选A.
从t2→t3的原因是盐酸的浓度逐渐降低,反应速率逐渐减小,镁的体积大小不影响反应速率,此时浓度因素大于温度的影响,则C、D错误.
故选A.
点评:本题考查化学反应速率的影响因素,侧重于图象的分析与基础知识的综合考查和运用,为高频考点,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
 将除去氧化膜的镁条投入到少量稀盐酸中进行实验,实验测得氢气的产生速率变化情况如图曲线所示,对该曲线的解释中正确的是( )
将除去氧化膜的镁条投入到少量稀盐酸中进行实验,实验测得氢气的产生速率变化情况如图曲线所示,对该曲线的解释中正确的是( )

