题目内容
【题目】某化学课外活动小组为了验证元素非金属性递变规律,设计了如图所示的两套实验方案(图1和图2)进行实验探究:
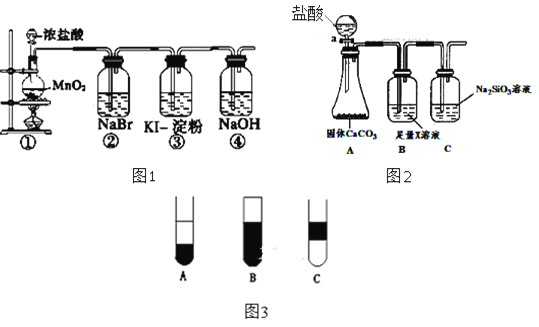
(1)根据方案一装置(图1)回答以下问题:
Ⅰ.写出装置①发生的化学反应方程式:______。
Ⅱ.若将反应后②中的溶液倒入CCl4中,出现的现象与图3吻合的是______。(填字母代号)
Ⅲ.装置③中的现象是______。
(2)根据方案二装置(图2)回答以下问题:
Ⅰ.B装置的作用是______,X是______。
Ⅱ.能说明碳元素和硅元素非金属性强弱的实验现象是______。
(3)实验结论:__________________________________________。
【答案】 MnO2+4HCl(浓)![]() Cl2↑+MnCl2+2H2O A 溶液变蓝色 吸收CO2中的HCl 饱和NaHCO3溶液 C中有白色沉淀产生 同主族元素从上到下,元素的非金属性逐渐减弱
Cl2↑+MnCl2+2H2O A 溶液变蓝色 吸收CO2中的HCl 饱和NaHCO3溶液 C中有白色沉淀产生 同主族元素从上到下,元素的非金属性逐渐减弱
【解析】(1)Ⅰ.二氧化锰和浓盐酸加热生成二氯化锰和氯气,反应方程式为MnO2+4HCl(浓)![]() Cl2↑+MnCl2+2H2O。Ⅱ.氯气的氧化性强于溴,故把氯气通入②中,氯气把溴离子氧化成单质溴,Cl2+2Br-=Br2+2Cl-,单质溴易溶于四氯化碳中,四氯化碳密度比水大,故溴的四氯化碳在下层,出现的现象与图③吻合的是A;Ⅲ.氯气把碘离子置换成单质碘,Cl2+2I-=I2+2Cl-,碘遇淀粉变蓝,故看到的现象为溶液变蓝色。(2)Ⅰ.根据题干信息:方案二根据元素非金属性与对应最高价含氧酸之间的关系,设计了同主族元素非金属性强弱比较的实验研究,碳酸酸性强于硅酸,最高价氧化物对应水化物酸性越强,则原子的非金属性越强,由于氯化氢易挥发,故B装置的作用是除去挥发的氯化氢,可用饱和碳酸氢钠溶液;Ⅱ.C中盛装硅酸钠溶液,由于碳酸酸性比硅酸强,在C中通入二氧化碳气体生成硅酸沉淀,因此能说明碳元素和硅元素非金属性强弱的实验现象是C中有白色沉淀产生。(3)根据以上分析可知实验结论是同主族元素从上到下,元素的非金属性逐渐减弱。
Cl2↑+MnCl2+2H2O。Ⅱ.氯气的氧化性强于溴,故把氯气通入②中,氯气把溴离子氧化成单质溴,Cl2+2Br-=Br2+2Cl-,单质溴易溶于四氯化碳中,四氯化碳密度比水大,故溴的四氯化碳在下层,出现的现象与图③吻合的是A;Ⅲ.氯气把碘离子置换成单质碘,Cl2+2I-=I2+2Cl-,碘遇淀粉变蓝,故看到的现象为溶液变蓝色。(2)Ⅰ.根据题干信息:方案二根据元素非金属性与对应最高价含氧酸之间的关系,设计了同主族元素非金属性强弱比较的实验研究,碳酸酸性强于硅酸,最高价氧化物对应水化物酸性越强,则原子的非金属性越强,由于氯化氢易挥发,故B装置的作用是除去挥发的氯化氢,可用饱和碳酸氢钠溶液;Ⅱ.C中盛装硅酸钠溶液,由于碳酸酸性比硅酸强,在C中通入二氧化碳气体生成硅酸沉淀,因此能说明碳元素和硅元素非金属性强弱的实验现象是C中有白色沉淀产生。(3)根据以上分析可知实验结论是同主族元素从上到下,元素的非金属性逐渐减弱。