题目内容
实验室配制500 mL 0.2 mol/L的Na2SO4溶液,实验操作步骤有:
A.在天平上称取一定质量的硫酸钠固体,把它放在烧杯中,用适量的蒸馏水使它完全溶解并冷却至室温;
B.把制得的溶液小心地转移到容量瓶中;
C.继续向容量瓶中加蒸馏水至液面距刻度线1~2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面最低处与刻度线相切;
D.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心注入容量瓶并轻轻振荡;
E.将容量瓶瓶塞塞紧,充分摇匀。
回答下列问题:
(1)操作步骤的正确顺序为(填序号) 。
(2)操作A中,在天平上称取硫酸钠固体的质量为 g。
(3)本实验用到的基本仪器已经有烧杯、天平(带砝码、镊子)、玻璃棒,还缺少的仪器是 。
(4)① 在配制溶液过程中,若缺少操作D,将使配制的溶液浓度 (填“偏高”或“偏低”或“无影响”)。② 操作C中加蒸馏水时,不慎超过了刻度线,将使配制的溶液浓度 (填“偏高”或“偏低”或“无影响”)。
(5)下列操作中,容量瓶所不具备的功能有 。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
汽车尾气是城市空气的主要污染物,如何减少汽车尾气(CO、NOx等)的污染是重要的科学研究课题。
(1)已知:N2(g)+O2(g)═2NO(g) △H1
N2(g)+3H2(g) 2NH3(g) △H2
2NH3(g) △H2
2H2(g)+O2(g)═2H2O(g) △H3
则4NO(g)+4NH3(g)+O2(g)═4N2(g)+6H2O(g)△H=____________(用含△H1、△H2、△H3的式子表达)
(2)汽车尾气中的CO、NOx都需要除去,有人设想按下列反应除去CO;2CO(g)=2C(s)+O2(g)
已知该反应在任何温度下都不能自发进行,因此该设想便不能实现。由此判断该反应的△H________0
目前,在汽车尾气系统中装置催化转化器可以减少CO、NO的污染,其化学反应方程式为____________________。
(3)可用活性炭还原法处理氮氧化物.有关反应的化学方程式为:
C(s)+2NO(g) N2(g)+CO2(g)△H>0
N2(g)+CO2(g)△H>0
某研究小组向密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测
C(s)+2NO(g) N2(g)+CO2(g)△H>0
N2(g)+CO2(g)△H>0
得各物质的浓度如下:
浓度/mol•L-1 时间/min | NO | N2 | CO2 |
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.040 | 0.030 | 0.030 |
30 | 0.040 | 0.030 | 0.030 |
40 | 0.032 | 0.034 | 0.017 |
则,30min后,改变某一条件,平衡发生了移动,则改变的条件是______________;若升高温度,NO浓度将__________(填“增大”、“不变”或“减小”).


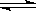 H++OH- △H>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是_____________(填字母序号)。
H++OH- △H>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是_____________(填字母序号)。 A.分别测等浓度的醋酸和氨水pH ,发现二者的pH 之和为14,说明常温下醋酸和氨水的电离平衡常数相等
A.分别测等浓度的醋酸和氨水pH ,发现二者的pH 之和为14,说明常温下醋酸和氨水的电离平衡常数相等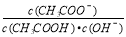 增大
增大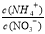 <1
<1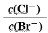 增大
增大 有0.1 mol·L-1醋酸溶液10 mL,加蒸馏水稀释到1 L后,下列变化中正确的是
有0.1 mol·L-1醋酸溶液10 mL,加蒸馏水稀释到1 L后,下列变化中正确的是 增大 ⑦c(OH-)增大
增大 ⑦c(OH-)增大