题目内容
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
①46 g NO2和N2O4混合气体中含有的原子数为3NA
②标准状况下22.4L H2中含有的中子数为2NA
③1L 1mol/L的醋酸溶液中含有的离子总数为2NA
④1mol Mg与足量O2或N2反应生成MgO或Mg3N2均失去2NA电子
⑤9 g重水(D2O)所含有的电子数为5NA
⑥1L 1mol/L的MgCl2溶液中含有的离子数为2NA
⑦7.1 g氯气与足量NaOH溶液反应,转移的电子数为0.2NA
⑧1mol C10H22分子中共价键总数为31NA
⑨2L 3mol/L的Na2CO3溶液中含CO![]() 的数目为6NA
的数目为6NA
⑩1.8 g NH![]() 中含有的电子数为NA
中含有的电子数为NA
A.①③⑥⑨⑩ B.②④⑤⑥ C.①④⑧⑩ D.④⑥⑦⑧⑩
【答案】C
【解析】
试题解析:①把N2O4看作是NO2,46g气体中原子物质的量为46×3/46mol=3mol,故正确;② H2中不含中子数,中子数为0,故错误;③醋酸是弱酸,不能完全电离,离子总物质的量小于1mol,故错误;④无论生成氧化镁还是氮化镁,1molMg失去电子的物质的量为2mol,故正确;⑤质量数=核素的近似相对原子量,D2O的相对原子量为20,因此所含电子的物质的量为9×10/20mol=4.5mol,故错误;⑥溶液中含有水,水能电离出H+和OH-,溶液中离子物质的量大于3mol,故错误;⑦Cl2+2NaOH=NaCl+NaClO+H2O,因此7.1gCl2参加反应转移电子物质的量为7.1/71mol=0.1mol,故错误;⑧该有机物为烷烃,含有共价键的物质的量为31mol,故正确;⑨CO32-+H2O![]() HCO3-+OH-,CO32-的物质的量小于6mol,故错误;⑩含有电子的物质的量为1.8×10/18mol=1mol,故正确;综上所述,故选项C正确。
HCO3-+OH-,CO32-的物质的量小于6mol,故错误;⑩含有电子的物质的量为1.8×10/18mol=1mol,故正确;综上所述,故选项C正确。

【题目】下面六个图中,横坐标为某溶液中加入某物质的量,纵坐标为生成沉淀的量。从A—F中选择符合表中各题要求的序号填入表中:
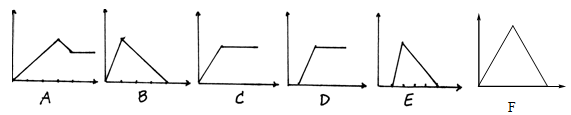
溶 液 | 加入的物质 | 答案序号 |
⑴饱和石灰水 | CO2 | |
⑵AlCl3溶液 | 过量NH3 | |
⑶含少量NaOH的NaAlO2 | 过量CO2 | |
⑷含少量NaOH的NaAlO2 | 逐滴加稀盐酸 | |
⑸MgCl2、AlCl3混合液 | 逐滴加NaOH至过量 | |
⑹NaOH溶液 | 逐滴加AlCl3至过量 |