题目内容
【题目】用石墨作电极电解AgNO3溶液,通电一段时间后,欲使电解液恢复到起始状态,应向溶液中加入适量的( )
A. AgNO3 B. H2O C. Ag2O D. Ag(NH3)2OH
【答案】C
【解析】试题分析:硝酸银溶液存在的阴离子为:NO3-.OH-,OH-离子的放电能力大于NO3-离子的放电能力,所以OH-离子放电生成氧气;溶液中存在的阳离子是Ag+、H+,Ag+离子的放电能力大于H+离子的放电能力,所以Ag+离子放电生成Ag;溶液变成硝酸溶液;电解硫酸铜的方程式为:4AgNO3+2H2O![]() 4Ag+O2+4HNO3;所以从溶液中析出的物质是氧气和银,因为氧气和银和稀硫酸都不反应,但和氧化银反应,氧气和银反应生成氧化银,所以向溶液中加入氧化银即可,故选C。
4Ag+O2+4HNO3;所以从溶液中析出的物质是氧气和银,因为氧气和银和稀硫酸都不反应,但和氧化银反应,氧气和银反应生成氧化银,所以向溶液中加入氧化银即可,故选C。

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目
【题目】下列各项中的物质,能满足如图中阴影部分关系的
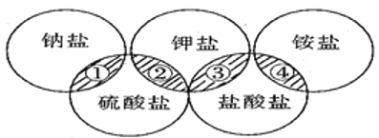
选项 | ① | ② | ③ | ④ |
A | NaCl | K2SO4 | KCl | (NH4)2SO4 |
B | NaCl | K2SO4 | KCl | NH4Cl |
C | Na2SO4 | K2SO4 | KCl | NH4Cl |
D | Na2SO4 | K2SO4 | KCl | (NH4)2SO4 |
A. A B. B C. C D. D