题目内容
两种盐的溶解度(g/100g水)
| 温度/℃物质 | 0 | 20 | 30 | 45 | 60 | 80 |
| Sr(NO3)2 | 28.2 | 40.7 | 47 | 47.2 | 48.3 | 49.2 |
| Ca(NO3)2?4H2O | 102 | 129 | 152 | 230 | 300 | 358 |
(2)由浸取后得到的混合物制备硝酸锶粗品的实验步骤依次为:①
(3)制得的硝酸锶粗品中含有少量Ca(NO3)2、Ba(NO3)2等杂质.实验室测定硝酸锶纯度的实验步骤如下:准确称取一定质量的硝酸锶样品,加入1:1无水乙醇与乙醚的混合液萃取硝酸钙,用水溶解分离硝酸钙后的样品,于250mL容量瓶中定容得样品溶液.准确移取25.00mL样品溶液,调节pH为7,加入指示剂,加热至微沸,立即用碳酸钠标准溶液滴定至终点.另取样品溶液用比浊法测得硝酸钡的含量.滴定过程中反应的离子方程式如下:
Sr2++C
| O | 2- 3 |
| O | 2- 3 |
①滴定选用的指示剂为
②若滴定前样品中Ca(NO3)2没有除尽,所测定的硝酸锶纯度将会
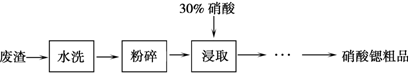
(2)废渣水洗除去可溶物,粉碎加硝酸浸取得到溶于水的硝酸盐,通过过滤,蒸发浓缩结晶,趁热过滤,洗涤干燥;
(3)①利用标准液碳酸钠溶液呈碱性,滴入碳酸钠沉淀钡离子和锶离子完全后,滴入最后一滴溶液呈红色说明反应完全;
②若滴定前样品中Ca(NO3)2没有除尽,多消耗标准溶液碳酸钠.
故答案为:增加反应物的接触面积,提高反应速率,提高原料的利用率;
(2)废渣水洗除去可溶物,粉碎加硝酸浸取得到溶于水的硝酸盐,通过过滤,蒸发浓缩结晶,趁热过滤,洗涤干燥,
故答案为:(趁热)过滤;故蒸发结晶;趁热过滤;
(3)①分析滴定过程可知,样品溶液无色,滴入碳酸钠沉淀完全可以滴入酚酞试液指示终点,滴入最后一滴溶液呈红色,半分钟内部褪色,
故答案为:酚酞;溶液由无变为浅红色30秒内不退色;
②若滴定前样品中Ca(NO3)2没有除尽,多消耗标准溶液碳酸钠,依据滴定误差分析,c(待测液)=
| c(标准液)V(标准液) |
| V(待测液) |
故答案为:偏高.

 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案锶(Sr)是人体必需的微量元素,其单质和化合物的化学性质与钙、钡的相似。实验室用含碳酸锶的废渣(含SrCO3 38.40%,SrO12.62%,CaCO3 38.27%,BaCO3 2.54%,其它不溶于硝酸的杂质8.17%)制备硝酸锶粗品的部分实验过程如下:

(1)市售浓硝酸的质量分数为65%,密度为1.4g/cm3,要配制30%稀硝酸500mL,还需要查阅的数据是 ,若配制过程中不使用天平,则必须要计算的数据是 ,必须要使用的仪器是 。
已知两种盐的溶解度(g/100 g水)如下表
|
温度/℃物质 |
0 |
20 |
30 |
45 |
60 |
80 |
100 |
|
Sr(NO3)2 |
28.2 |
40.7 |
47 |
47.2 |
48.3 |
49.2 |
50.7 |
|
Ca(NO3)2·4H2O |
102 |
129 |
152 |
230 |
300 |
358 |
408 |
(2)由浸取后得到的混合物制备硝酸锶粗品的实验步骤依次为:过滤、 、 、洗涤,干燥。
已知,硝酸钙能溶于有机溶剂A中。式量:Sr(NO3)2–212、Ba(NO3)2–261、Ca(NO3)2–164
(3)制得的硝酸锶粗品中含少量Ca(NO3)2、Ba(NO3)2等杂质。测定硝酸锶纯度的实验如下:称取5.39g硝酸锶样品,加入足量的有机溶剂A,经过滤、洗涤、干燥后,剩余固体5.26g,将此固体配成250 mL的溶液,取出25.00 mL,调节pH为7,加入指示剂,用浓度为0.107mol/L的碳酸钠溶液滴定至终点,消耗碳酸钠溶液22.98mL。
滴定过程的反应:Sr2++CO32-→ SrCO3↓ Ba2++CO32-→ BaCO3↓
①滴定选用的指示剂为 ,滴定终点观察到的现象为 。
②该硝酸锶粗品中,硝酸锶的质量分数为 (小数点后保留两位)。若滴定前样品中Ca(NO3)2没有除尽,所测定的硝酸锶纯度将会 (填“偏高”、“偏低”或“不变”)。
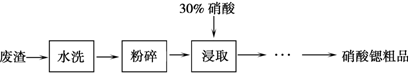
硝酸锶[Sr(NO3)2]常作为制备焰火、信号弹的原料.实验室以生产碳酸锶工厂的废渣(含SrCO3 38.40%,SrO12.62%,CaCO3 38.27%,BaCO3 2.54%,MgCO3 1.88%,其它不溶于硝酸的杂质6.29%)为原料制备硝酸锶粗品的部分实验过程如下:
两种盐的溶解度(g/100g水)
| 温度/℃物质 | 0 | 20 | 30 | 45 | 60 | 80 |
| Sr(NO3)2 | 28.2 | 40.7 | 47 | 47.2 | 48.3 | 49.2 |
| Ca(NO3)2?4H2O | 102 | 129 | 152 | 230 | 300 | 358 |
(2)由浸取后得到的混合物制备硝酸锶粗品的实验步骤依次为:①______;②______;③______;④洗涤,干燥.
(3)制得的硝酸锶粗品中含有少量Ca(NO3)2、Ba(NO3)2等杂质.实验室测定硝酸锶纯度的实验步骤如下:准确称取一定质量的硝酸锶样品,加入1:1无水乙醇与乙醚的混合液萃取硝酸钙,用水溶解分离硝酸钙后的样品,于250mL容量瓶中定容得样品溶液.准确移取25.00mL样品溶液,调节pH为7,加入指示剂,加热至微沸,立即用碳酸钠标准溶液滴定至终点.另取样品溶液用比浊法测得硝酸钡的含量.滴定过程中反应的离子方程式如下:
Sr2++C
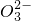 ═SrCO3↓ Ba2++C
═SrCO3↓ Ba2++C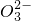 ═BaCO3↓
═BaCO3↓①滴定选用的指示剂为______,滴定终点观察到的现象为______.
②若滴定前样品中Ca(NO3)2没有除尽,所测定的硝酸锶纯度将会______(填“偏高”、“偏低”或“不变”).
 Sr2+(aq)+SO2-4(aq)KSP=2.5×10-7
Sr2+(aq)+SO2-4(aq)KSP=2.5×10-7