题目内容
设NA为阿伏加德罗常数的值,下列有关叙述正确的是
A.标准状况下,1L庚烷完全燃烧后,所生成的气态产物的分子数为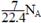 |
| B.100 mL 0.1 mol/L CH3COOH溶液跟足量锌反应,生成的氢气分子数为0.01 NA |
| C.0.1 mol CH4所含质子数为NA |
| D.0.5mol C2H4中含有的C=C双键数为NA |
C
解析试题分析:A庚烷属于液体,故A错,B,Zn+2CH3COOH→H2↑+(CH3COO)2 +Zn所以100 mL 0.1 mol/L CH3COOH溶液跟足量锌反应,生成的氢气分子数为0.005NA故B错,C选项质子数等于原子序数故一个甲烷分子的质子数等于10.故0.1 mol CH4所含质子数为NA所以C选项正确。D.0.5mol C2H4中含有的C=C双键数为0.5NA故D错。
考点:考查阿伏伽德罗常数计算的相关知识点。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
| |||||
| |||||||||||||||
你认为下列数据可信的是 ( )
| A.某雨水的pH为5.6 |
| B.某澄清石灰水的浓度是2.0 mol/L |
| C.某胶体粒子的直径是160 nm |
| D.某常见气体的密度为1.8 g/cm3 |
设NA为阿伏加德罗常数的值。下列叙述不正确的是( )
| A.7.80g Na2O2与5.85g NaCl所含阴离子数均为0.1NA |
| B.常温常压下,22.4LNH3所含分子数小于NA |
| C.一定条件下,1.4g N2与0.2mol H2混合充分反应,转移的电子数为0.3NA |
| D.标准状况下,28g聚乙烯完全燃烧,产生的CO2数为2NA |
mg气体A和ng气体B的分子数相等,下列说法不正确的是( )
| A.同体积的气体A和气体B的质量比为m:n |
| B.25℃时,1kg气体A和1kg气体B的分子数比为n: m |
| C.同温同压时气体A和气体B的密度比为n:m |
| D.标况时,等质量的A和B气体的体积比为n:m |
在两个容积相同的容器中,一个盛有HCl气体,另一个盛有H2和Cl2的混合气体。在同温同压下,两容器内的气体一定具有相同的
| A.原子数 | B.密度 | C.质量 | D.质子数 |
NA表示阿伏加德罗常数,下列叙述正确的是
| A.lmol FeI2与足量氯气反应时转移的电子数为2NA |
| B.乙烯和丙烯组成的42 g混合气体中氢原子的个数为6 NA |
| C.1 mol Na2O2固体中含离子总数为4NA |
| D.2 L0.5 mol ? L-1硫酸钾溶液中阴离子所带电荷数为NA |