题目内容
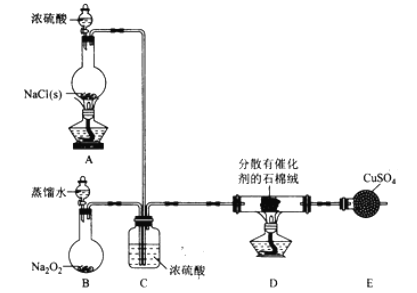
【题目】实验室用下图装置测定FeO和Fe2O3固体混合物中Fe2O3的质量,D装置的硬质双通玻璃管中的固体物质是FeO和Fe2O3的混合物。

(1)为了安全,在点燃D处的酒精灯之前,在b处必须_____________。
(2)装置B的作用是_____________,装置C中盛装的液体是_____________。
(3)若为FeO和Fe2O3物质的量之比1:1的固体混合物,反应完全后,U型管的质量增加7.2g,则混合物中Fe2O3的质量为____________________。
(4)U型管E右边连接干燥管F的目的是_______________________,若无干燥管F,测得Fe2O3的质量将_____________(填“偏大”“偏小”或“无影响”)。
【答案】验纯 除HCl 浓H2SO4 16 g 防止空气中水蒸气进入 偏大
【解析】
(1)根据氢气是可燃性气体分析判断;
(2)根据生成的氢气中含有氯化氢和水蒸气分析判断;
(3)U型管的作用为吸收水,增加的质量则为水的质量,据此解答;
(4)根据空气中含有水蒸气分析判断。
(1)根据实验装置可确定,装置A为制取氢气的装置,装置D为还原装置,加热前需要确定氢气在装置中的纯度,若在爆炸范围内,加热会发生爆炸,故在加热前需要收集气体进行验纯操作;
(2)盐酸具有挥发性,制取的气体中会混有HCl气体,装置B的作用为除去HCl气体;由于需要通过测定水的含量来确定氧化铁含量,则装置C需要除去水蒸气,则用浓硫酸干燥氢气;
(3)U型管的作用为吸收水,增加的质量则为水的质量,7.2g水为0.4mol,FeO和Fe2O3物质的量之比1∶1的固体混合物,根据氧原子守恒可知Fe2O3的物质的量为0.1mol,质量为16g;
(4)由于空气中还含有水蒸气,则干燥管F的作用为防止空气中的水蒸气进入装置E。若无干燥管F,则导致水的含量偏大,从而导致氧化铁的含量偏大。

【题目】用软锰矿[主要成分MnO2,还含SiO2 、Fe2O3、Al2O3、Cu2(OH)2CO3的等杂质]和酸洗厂废酸液(含1mol/LH2SO4的FeSO4溶液)联合生产硫酸锰和铁红(Fe2O3)生产过程如下

Mn(OH)2 | Fe(OH)2 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | |
开始沉淀时 | 8.3 | 6.3 | 4.7 | 3.4 | 2.7 |
完全沉淀时 | 9.8 | 8.3 | 6.7 | 4.4 | 3.2 |
(1)含杂质的软锰矿使用前需将其粉碎,目的是______。
(2)滤渣1中含有的主要物质是_______。
(3)滤液1中,加氨水调控溶液pH至3.2,通入O2,反应的离子方程式是_______。若用H2O2代替O2,是否合理?理由是___________。
(4)软锰矿粉与硫酸和硫酸亚铁溶液反应的离子方程式是_________。
(5)滤液3中加入难溶电解质MnS的目的是(用离子方程式表示)_________。
(6)用重结晶法从滤液4中获取硫酸锰晶体的操作是:__________。
【题目】亚硝酸氯(ClNO)可由NO与Cl2在通常条件下反应得到,化学方程式为:2NO(g)+Cl2(g)![]() 2ClNO(g)。
2ClNO(g)。
(1)在一定温度下,该反应于一恒容密闭容器中达到平衡继续通入Cl2,逆反应速率____(填增大、减少、不变)。
(2)已知几种化学键的键能数据如下表(NO的结构为:N≡O;亚硝酸氯的结构为Cl-N=O)
化学键 | N≡O | Cl-Cl | Cl-N | N=O |
键能(kJ/mol) | 630 | 243 | a | 607 |
2NO(g)+Cl2(g)![]() 2ClNO(g) △H=-111kJ/mol则a=______。
2ClNO(g) △H=-111kJ/mol则a=______。
(3)在1L的恒容密闭容器中充入2molNO(g)和1molCl2(g),在不同温度下测得c(ClNO)与时间的关系如图A:
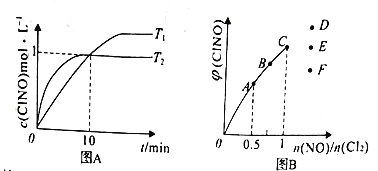
①该反应的T1______T2(填“>”<”或“=”)。
②反应开始到10min时NO的平均反应速率v(NO)=_______mol/(L.min)。
③T2时该反应的平衡常数K=________。
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化图象如图B,则A、B、C三状态中,NO的转化率最大的是_____点,当n(NO)/n(Cl2)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的____点。