题目内容
12.下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以左右自由滑动的隔板(其质量忽略不计).其中能表示相同温度时,等质量的氢气与氦气的是( )| A. |  | B. | 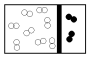 | C. |  | D. |  |
分析 白球代表氢原子,黑球代表氦原子,等质量的氢气与氦气,其物质的量之比=$\frac{mg}{2g/mol}$:$\frac{mg}{4g/mol}$=2:1,相同条件下其体积之比为2:1,据此进行解答.
解答 解:设氢气与氦气都为mg,则二者的物质的量之比为$\frac{mg}{2g/mol}$:$\frac{mg}{4g/mol}$=2:1,则体积之比为2:1;
A.白球代表氢原子,黑球代表氦原子,符合物质的量之比为2:1,体积之比为2:1,故A正确;
B.白球代表氢原子,黑球代表氦原子,物质的量之比=8:2=4:1,且氦气是单原子构成的分子,不满足条件,故B错误;
C.白球代表氢原子,黑球代表氦原子,物质的量之比2:1,但体积之比为1:2,故C错误;
D.白球代表氢原子,黑球代表氦原子,物质的量之比为1:1,体积之比为2:1,故D错误;
故选A.
点评 本题考查阿伏伽德罗定律,题目难度不大,明确等质量的气体中物质的量和体积的关系是解答的关键,并注意氦气的构成来解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.已知H2C2O4是二元弱酸,室温下向某浓度的草酸溶液中逐滴加入KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-的组成百分率与pH的关系如图所示:下列说法正确的是( )

| A. | pH=2.7的溶液中:$\frac{{c}^{2}(H{C}_{2}{O}_{4}^{-})}{c({H}_{2}{C}_{2}{O}_{4})×c({C}_{2}{O}_{4}^{2-})}$=10-2.97 | |
| B. | pH=4.27的溶液中,c(K+)+c(H+)=c(OH-)+3c(C2O42-) | |
| C. | 反应HC2O4-+H2O?H2C2O4+OH-的平衡常数为10-4.27 | |
| D. | 向溶液中加KOH溶液将pH由1.30增大至4.27的过程中水的电离程度先增大后减小 |
7.对Na2O和Na2O2的叙述正确的是( )
| A. | Na2O与Na2O2均可与水反应放出氧气 | |
| B. | Na2O和Na2O2中的元素的化合价均相同 | |
| C. | Na2O2与H2O反应为放热反应 | |
| D. | 在呼吸面具中,Na2O常作供氧剂 |
17.下列比较正确的是( )
| A. | 熔沸点高低:CH4<SiH4<GeH4<SnH4 | |
| B. | 离子半径大小:Cl-<Mg2+<O2-<F- | |
| C. | 分散质微粒直径大小:Fe(OH)3胶体>CaCO3悬浊液>NaCl溶液 | |
| D. | 酸性强弱:H2SO4<H3PO4<H2SiO3 |
4.对乙酰氨基酚(俗称扑热息痛)具有很强的解热镇痛作用,其结构如图所示,
下列有关对乙酰氨基酚说法错误的是( )

下列有关对乙酰氨基酚说法错误的是( )
| A. | 1mol该物质最多消耗2molNaOH | B. | 该物质的分子式为C8H8NO2 | ||
| C. | 该物质能发生取代反应和加成反应 | D. | 该物质苯环上的一溴代物有2种 |
1.能正确表示下列反应的离子方程式的是( )
| A. | 将铜屑加入 Fe3+溶液中:2Fe3++Cu=2Fe2++Cu2+ | |
| B. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═3Fe3++4H2O | |
| C. | 将氯化亚铁酸性溶液和H2O2混合:Fe2++2H++H2O2═Fe3++2H2O | |
| D. | 将铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ |
17.某研究性学习小组在网上收集到如下信息:Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰.他们对蚀刻银的原因进行了如下探究:
【实验】制作银镜,并与Fe(NO3)3溶液反应,发现银镜溶解.
(1)下列有关利用Fe粉与稀HNO3制备Fe(NO3)3溶液的方法,最佳的是c.
a.把过量的铁粉与稀HNO3 反应
b.把铁粉与过量的稀HNO3 反应
c.先把铁粉灼烧,再溶解于稀HNO3中
【提出假设】
假设1:Fe3+具有氧化性,能氧化Ag.
假设2:显酸性,在此酸性条件下NO3-能氧化Ag.
【设计实验方案,验证假设】
(2)甲同学为了验证假设1,取上述实验后的溶液,检验Fe2+.检验Fe2+的方法:取少量溶液于试管中,滴加1-2滴酸性KMnO4溶液,振荡,甲同学观察到的实验现象为:溶液的紫红色褪去,甲同学检验出Fe2+,验证了假设1的成立.请写出Fe3+氧化Ag的离子方程式:Fe3++Ag=Fe2++Ag+.
(3)乙同学设计实验验证假设2.请写出在酸性条件下NO3-氧化Ag的离子方程式:3Ag+4H++NO3-=3Ag++NO↑+2H2O.并帮乙同学完成下表中内容(提示:NO3-在不同条件下的还原产物较复杂,有时难以观察到气体产生,乙同学放弃了检验NO3-在不同条件下的还原产物的方法).
[思考与交流]
(4)甲同学验证了假设1成立,若乙同学验证了假设2也成立.则丙同学由此得出结论:Fe(NO3)3溶液中的Fe3+和NO3-都氧化了Ag.你是否同意丙同学的结论,并简述理由:不同意,甲同学检验出了Fe2+,可确定Fe3+一定氧化了Ag;乙同学虽然验证了此条件下NO3-能氧化Ag,但在硝酸铁溶液氧化Ag时,由于没有检验NO3-的还原产物,因此不能确定NO3-是否氧化了Ag.
【实验】制作银镜,并与Fe(NO3)3溶液反应,发现银镜溶解.
(1)下列有关利用Fe粉与稀HNO3制备Fe(NO3)3溶液的方法,最佳的是c.
a.把过量的铁粉与稀HNO3 反应
b.把铁粉与过量的稀HNO3 反应
c.先把铁粉灼烧,再溶解于稀HNO3中
【提出假设】
假设1:Fe3+具有氧化性,能氧化Ag.
假设2:显酸性,在此酸性条件下NO3-能氧化Ag.
【设计实验方案,验证假设】
(2)甲同学为了验证假设1,取上述实验后的溶液,检验Fe2+.检验Fe2+的方法:取少量溶液于试管中,滴加1-2滴酸性KMnO4溶液,振荡,甲同学观察到的实验现象为:溶液的紫红色褪去,甲同学检验出Fe2+,验证了假设1的成立.请写出Fe3+氧化Ag的离子方程式:Fe3++Ag=Fe2++Ag+.
(3)乙同学设计实验验证假设2.请写出在酸性条件下NO3-氧化Ag的离子方程式:3Ag+4H++NO3-=3Ag++NO↑+2H2O.并帮乙同学完成下表中内容(提示:NO3-在不同条件下的还原产物较复杂,有时难以观察到气体产生,乙同学放弃了检验NO3-在不同条件下的还原产物的方法).
| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| 测定上述实验用的Fe(NO3)3溶液的pH 配制相同pH的稀硝酸 溶液,并将适量此溶液加入有银镜的试管内. | 若银镜消失,假设2成立. 若银镜不消失,假设2不成立. |
(4)甲同学验证了假设1成立,若乙同学验证了假设2也成立.则丙同学由此得出结论:Fe(NO3)3溶液中的Fe3+和NO3-都氧化了Ag.你是否同意丙同学的结论,并简述理由:不同意,甲同学检验出了Fe2+,可确定Fe3+一定氧化了Ag;乙同学虽然验证了此条件下NO3-能氧化Ag,但在硝酸铁溶液氧化Ag时,由于没有检验NO3-的还原产物,因此不能确定NO3-是否氧化了Ag.
 钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途.
钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途.
