题目内容
8.我国四大发明之一的黑火药是由硫粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸 时的反应为S+2KNO3+3C=K2S+N2↑+3CO2↑中.该反应中还原剂是C,氧化剂是S、KNO3;当有1mol硫参加反应时转移的电子数为12mol,此时生成标准状况下氮气22.4L,同时需要碳粉36g.分析 该反应中,硫元素化合价由0价变为-2价,N元素化合价由+5价变为0价,碳元素化合价由0价变为+4价,根据元素化合价变化判断氧化剂和还原剂,当有1mol硫参加转移电子的物质的量为1mol×(5×2+2)=12mol,以此计算解答.
解答 解:反应S+2KNO3+3C═K2S+N2↑+3CO2↑中,S元素化合价由0价降低到-2价,则S为氧化剂,N元素化合价由+5价降低到0价,则KNO3为氧化剂,C元素化合价由0价升高到+4价,则C为还原剂,当1molS参加反应时,转移电子的物质的量为1mol×(5×2+2)=12mol,此时生成标准状况下氮气22.4L,同时需要碳粉3×12=36g,
故答案为:C;S、KNO3;12;22.4;36.
点评 本题考查氧化还原反应,把握变化中元素的化合价为解答的关键,侧重氧化还原反应基本概念及电子转移的考查,注意从元素化合价角度分析,题目难度不大.

练习册系列答案
相关题目
18.米易龙潭溶洞景区被誉为天然氧吧,其原因是空气中的自由电子附着在分子或原子上形成空气负离子,被称为“空气维生素”.O2-就是一种空气负离子,其摩尔质量为( )
| A. | 32 g | B. | 33 g/mol | C. | 33 g | D. | 32 g/mol |
19.120℃时,将0.1mol某气态烃在足量的氧气中完全燃烧,测得反应前后气体体积相等,则该气态烃可能
( )
( )
| A. | 乙烷 | B. | 乙烯 | C. | 丙烷 | D. | 苯 |
16.若要检验酒精中是否含有少量水,可选用的试剂是M.制取无水酒精时,通常需向工业酒精中加入物质N,并加热蒸馏.则M、N分别应是( )
| A. | 生石灰、无水硫酸铜 | B. | 无水硫酸铜、浓硫酸 | ||
| C. | 无水硫酸铜、生石灰 | D. | 金属钠、生石灰 |
3.要证明CuSO4溶液显蓝色不是由于SO42-离子造成的,下列实验无意义的是( )
| A. | 观察K2SO4溶液的颜色 | |
| B. | 向CuSO4溶液中滴加适量的NaOH溶液,振荡后静置,溶液颜色消失 | |
| C. | 加水稀释后CuSO4溶液颜色变浅 | |
| D. | 向CuSO4溶液中滴加适量的Ba(NO3)2溶液,振荡后静置,溶液颜色未消失 |
13.已知:C(s)+O2(g)═CO2(g);△H1
C(s)+CO2(g)═2CO(g);△H2
2CO(g)+O2(g)═2CO2(g);△H3
4Fe(s)+3O2(g)═2Fe2O3(s);△H4
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g);△H5
下列关于上述反应焓变的判断正确的是( )
C(s)+CO2(g)═2CO(g);△H2
2CO(g)+O2(g)═2CO2(g);△H3
4Fe(s)+3O2(g)═2Fe2O3(s);△H4
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g);△H5
下列关于上述反应焓变的判断正确的是( )
| A. | △H1>0,△H5<0 | B. | △H2>0,△H4>0 | C. | △H1=△H2+△H3 | D. | △H3=△H4+△H5 |
20.金属与不同浓度的硝酸反应时,往往生成多种不同价态的还原产物.图d是各种不同密度的硝酸与铁反应时(相同温度)还原产物的分布图.下列说法不正确的是( )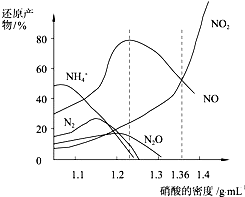

| A. | 密度小于1.1g/mL的硝酸与金属反应,还原产物主要是NH4+ | |
| B. | 当硝酸溶液的密度为1.36g/mL时,Fe与过量硝酸反应的化学方程式为:4Fe+18HNO3=4Fe(NO3)3+3NO+3NO2+9H2O | |
| C. | 稀硝酸与金属反应,一定被还原成NO | |
| D. | 某硝酸试剂瓶的标签注明:密度1.26g/mL,质量分数50.0%;若取该试剂10mL配成1000mL溶液,所得溶液的物质的量浓度为1 mol/L |
17.下列实验过程中涉及的离子反应方程式肯定正确的是( )
| A. | 除去硫酸铜溶液中的硫酸亚铁以最终制备胆矾晶体:2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 含有Mn2+的溶液中加入HNO3酸化,再加入PbO2,反应体系显紫红色:5PbO2+2Mn2++4H+═5Pb2++2MnO4-+2H2O | |
| C. | 向Ba(OH)2溶液中加入过量的NH4HSO4溶液:Ba2++2OH-+NH4++H++SO42-═BaSO4↓+NH3•H2O+H2O | |
| D. | 氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O |
18.标况下,将4.8g铜和镁的合金溶于浓硝酸,同条件下测得反应中产生两种气体及体积分别为NO2(4.48L)、N2O4(0.336L),在反应后的溶液中,加入足量的NaOH溶液,则生成的沉淀总质量为( )
| A. | 8.71g | B. | 8.86g | C. | 9.06g | D. | 7.04g |