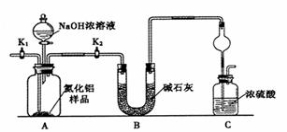
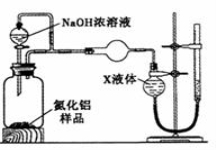
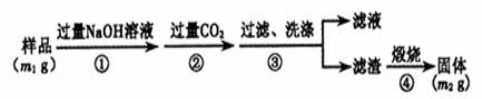
��Ŀ����
��֪����ʵ����ʵ����Cr2O3����� ������KOH��Һ�õ�KCrO2��Һ��������������õ�Cr2��SO4��3��Һ������KCrO2��Һ�еμ�H2O2��Һ�����ữ���ɵ�K2Cr2O7��Һ���۽�K2Cr2O7��ҺҺ�μӵ����ۺ�KI�Ļ����Һ�У���Һ�����������жϲ���ȷ���ǣ� ��
A��������KCrO2��CrԪ��Ϊ+3��
B��ʵ���֤��Cr2O3�����������
C��ʵ���֤��H2O2�������������л�ԭ��
D��ʵ���֤�������ԣ�Cr2O72->I2
 �����Ծ�ϵ�д�
�����Ծ�ϵ�д� �ο�����������100��ϵ�д�
�ο�����������100��ϵ�д�CO��CO2�ǻ������糧�ͷų�����Ҫβ����Ϊ���ٶԻ�����ɵ�Ӱ�죬���糧��ͼ�������·���������Դ�����ã����»��ȼ�ϻ���Ҫ��ҵ��Ʒ��

��1��CO��Cl2�ڴ����������ºϳɹ�����COCl2����ij�¶��£���2L���ܱ�������Ͷ��һ������CO��Cl2���ڴ����������·�����Ӧ��CO��g��+Cl2��g�� COCl2��g����H=a kJ/mol��Ӧ�����вⶨ�IJ����������±���
COCl2��g����H=a kJ/mol��Ӧ�����вⶨ�IJ����������±���
t/min | n ��CO��/mol | n ��Cl2��/mol |
0 | 1.20 | 0.60 |
1 | 0.90 | |
2 | 0.80 | |
4 | 0.20 |
�ٷ�Ӧ0��2minĩ��ƽ������v��COCl2��= mol/��L��min����
����2min��4min�䣬v��Cl2���� v��Cl2���� �����������=�������������¶��� K= ��
K= ��
����֪X��L�ɷֱ�����¶Ȼ�ѹǿ��ͼ1��ʾLһ��ʱ��CO��ת������X�ı仯��ϵ��
X�������������� ��a 0 �����������=��������������
��2���ڴ���������NO��COת��Ϊ�����壬2CO��g��+2NO��g�� 2CO2��g��+N2��g����H=��748kJ��mol��1
2CO2��g��+N2��g����H=��748kJ��mol��1
��һ�������£���λʱ���ڲ�ͬ�¶��²ⶨ�ĵ�������ת������ͼ2��ʾ���¶ȸ���710Kʱ�����¶ȵ����ߵ�������ת���ʽ��͵�ԭ������� ��
����֪���ⶨ������NO��CO�������õķ��������֣�����1���绯ѧ������������������CO�������Ĺ���ԭ����ͼ3��ʾ�������缫�ķ�ӦʽΪ ������2��������ԭ�ζ�������H2O2��Һ����β��������������ת��Ϊǿ�ᣬ������к͵ζ����ⶨǿ��Ũ�ȣ�д��NO��H2O2��Һ��Ӧ�����ӷ���ʽ ��
��3����CO��H2�����Ʊ��״�����ӦΪCO��g��+2H2��g�� CH3OH��g�����Լ״�Ϊȼ�ϣ�����Ϊ��������KOH��ҺΪ�������Һ�����Ƴ�ȼ�ϵ�أ��缫����Ϊ���Ե缫�����������Һ��K
CH3OH��g�����Լ״�Ϊȼ�ϣ�����Ϊ��������KOH��ҺΪ�������Һ�����Ƴ�ȼ�ϵ�أ��缫����Ϊ���Ե缫�����������Һ��K OH�����ʵ���Ϊ0.8mol������0.5mol�״����뷴Ӧʱ���������Һ�и������ӵ����ʵ���Ũ���ɴ�С��˳���� ��
OH�����ʵ���Ϊ0.8mol������0.5mol�״����뷴Ӧʱ���������Һ�и������ӵ����ʵ���Ũ���ɴ�С��˳���� ��
A��B��C����ǿ����ʣ�������ˮ�е�������������±���ʾ��
������ | Na+��K+��Cu2+ |
������ | SO42-��OH- |
����ͼ��ʾװ���У��ס��ҡ��������ձ����ηֱ�ʢ��������A��Һ��������B��Һ��������C��Һ���缫��Ϊʯī�缫����ͨ��Դ������һ��ʱ�������ձ���c�缫����������16g�������¸��ձ�����Һ��pH����ʱ��t�Ĺ�ϵ��ͼ���ݴ˻ش��������⣺
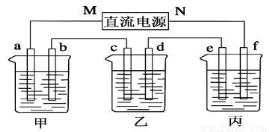
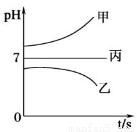
��1��MΪ��Դ��_______________������������������缫b�Ϸ����ĵ缫��ӦΪ_____________��
��2���缫e�����ɵ������ڱ�״̬�µ����Ϊ________��
��3��д�����ձ��еĵ��ط�Ӧ___________________��
��4�����������У����ձ��е�B��Һ�еĽ�������ȫ����������ʱ���ܼ������У�ԭ����________________��
��5��������һ��ʱ�������ձ���c�缫����������16g��Ҫʹ���ձ��е�C��Һ�ָ���ԭ����״̬����ȷ�IJ�����________________��


 ��Ϣ�����ڻ�ѧʵ�����й㷺��Ӧ�á�ijС���ô��м����ⶨ��Ȫʵ���е�ѹǿ�仯����ʶ��Ȫʵ���ԭ��(��ͼ1��ʾ)�����ⶨ����ƽ�ⳣ��Kb��
��Ϣ�����ڻ�ѧʵ�����й㷺��Ӧ�á�ijС���ô��м����ⶨ��Ȫʵ���е�ѹǿ�仯����ʶ��Ȫʵ���ԭ��(��ͼ1��ʾ)�����ⶨ����ƽ�ⳣ��Kb��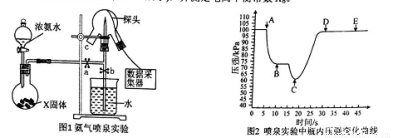

 �г�װ������ȥ����
�г�װ������ȥ����