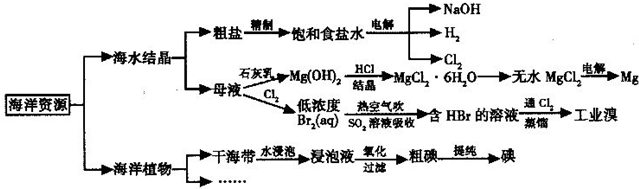
题目内容
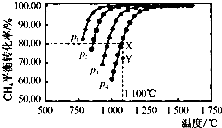 (2013?盐城一模)在密闭容器中通入物质的量浓度均为0.1mol?L-1的CH4与CO2,在一定条件下发生反应:CO2(g)+CH4 (g)?2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图,下列有关说法一定正确的是( )
(2013?盐城一模)在密闭容器中通入物质的量浓度均为0.1mol?L-1的CH4与CO2,在一定条件下发生反应:CO2(g)+CH4 (g)?2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图,下列有关说法一定正确的是( )分析:A.由图可知,压强一定时,温度越高甲烷的转化率越大,升高温度平衡向正反应进行,据此判断;
B.由图可知,温度一定时,甲烷的转化率α(P1)>α(P2)>α(P3)>α(P4),据此结合方程式判断压强对平衡移动的影响进行解答;
C.由图可知,压强为P4、1100℃的条件下,到达平衡X点时甲烷的转化率为80%,据此计算甲烷的浓度变化量,利用三段式计算平衡时各组分的平衡浓度,代入平衡常数表达式计算该温度下的平衡常数;
D.由图可知,压强为P4、1100℃的条件下,到达平衡X点时甲烷的转化率为80%,Y点甲烷的转化率小于80%,反应向正反应进行,据此判断.
B.由图可知,温度一定时,甲烷的转化率α(P1)>α(P2)>α(P3)>α(P4),据此结合方程式判断压强对平衡移动的影响进行解答;
C.由图可知,压强为P4、1100℃的条件下,到达平衡X点时甲烷的转化率为80%,据此计算甲烷的浓度变化量,利用三段式计算平衡时各组分的平衡浓度,代入平衡常数表达式计算该温度下的平衡常数;
D.由图可知,压强为P4、1100℃的条件下,到达平衡X点时甲烷的转化率为80%,Y点甲烷的转化率小于80%,反应向正反应进行,据此判断.
解答:解:A.由图可知,压强一定时,温度越高甲烷的转化率越大,升高温度平衡向正反应进行,故正反应为吸热反应,即△H>0,故A正确;
B.由图可知,温度一定时,甲烷的转化率α(P1)>α(P2)>α(P3)>α(P4),该反应正反应是气体体积增大的反应,增大压强平衡向逆反应进行,甲烷的转化率降低,故压强P4>P3>P2>P1,故B错误;
C.由图可知,压强为P4、1100℃的条件下,达到平衡X点时甲烷的转化率为80%,甲烷的浓度变化量为0.1mol/L×80%=0.08mol/L,则:
CH4(g)+CO2(g)=2CO(g)+2H2(g),
开始(mol/L):0.1 0.1 0 0
变化(mol/L):0.08 0.08 0.16 0.16
平衡(mol/L):0.02 0.02 0.16 0.16
故该温度下平衡常数k=
=1.64,故C错误;
D.由图可知,压强为P4、1100℃的条件下,到达平衡X点时甲烷的转化率为80%,Y点甲烷的转化率小于80%,反应向正反应进行,故在Y点:v(正)>v(逆),故D错误;
故选A.
B.由图可知,温度一定时,甲烷的转化率α(P1)>α(P2)>α(P3)>α(P4),该反应正反应是气体体积增大的反应,增大压强平衡向逆反应进行,甲烷的转化率降低,故压强P4>P3>P2>P1,故B错误;
C.由图可知,压强为P4、1100℃的条件下,达到平衡X点时甲烷的转化率为80%,甲烷的浓度变化量为0.1mol/L×80%=0.08mol/L,则:
CH4(g)+CO2(g)=2CO(g)+2H2(g),
开始(mol/L):0.1 0.1 0 0
变化(mol/L):0.08 0.08 0.16 0.16
平衡(mol/L):0.02 0.02 0.16 0.16
故该温度下平衡常数k=
| 0.162×0.162 |
| 0.02×0.02 |
D.由图可知,压强为P4、1100℃的条件下,到达平衡X点时甲烷的转化率为80%,Y点甲烷的转化率小于80%,反应向正反应进行,故在Y点:v(正)>v(逆),故D错误;
故选A.
点评:本题考查化学平衡图象、影响化学平衡的因素、化学平衡常数等,难度中等,注意利用“定一议二”原则分析解答.

练习册系列答案
相关题目