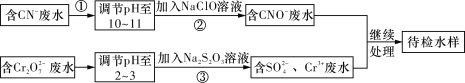
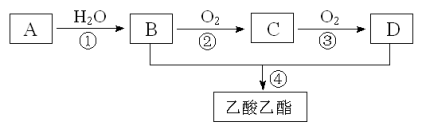
题目内容
【题目】用惰性电极电解一定浓度的CuSO4溶液时,通电一段时间后,向所得的溶液中加入0.1 mol Cu2(OH)2CO3后,恰好恢复到电解前的浓度和pH(不考虑二氧化碳的溶解)。则电解过程中转移的电子的物质的量为( )
A. 0.4 mol B. 0.5 mol
C. 0.6 mol D. 0.8 mol
【答案】C
【解析】试题分析:Cu2(OH)2CO3与H2SO4反应的化学方程式为:Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O,生成0.2mol CuSO4和0.3mol H2O,则有0.2mol的CuSO4发生电解反应:2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,根据对应关系:CuSO4~2e,转移电子的物质的量为0.4mol,电解0.2mol CuSO4时同时消耗0.2mol H2O,则电解H2O物质的量为0.3mol—0.2mol=0.1mol,2H2O
2Cu+O2↑+2H2SO4,根据对应关系:CuSO4~2e,转移电子的物质的量为0.4mol,电解0.2mol CuSO4时同时消耗0.2mol H2O,则电解H2O物质的量为0.3mol—0.2mol=0.1mol,2H2O![]() 2H2↑+O2↑,对应关系为:H2O~2e,电子转移为0.2mol,所以电解过程中转移的电子的物质的量为:0.4mol+0.2mol=0.6mol,故C项正确。
2H2↑+O2↑,对应关系为:H2O~2e,电子转移为0.2mol,所以电解过程中转移的电子的物质的量为:0.4mol+0.2mol=0.6mol,故C项正确。

 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案【题目】下表是实验室制备气体的有关内容:
编号 | 实验内容 | 实验原理 | 气体发生装置 |
① | 制备氧气 | H2O2→O2 | __________________ |
② | 制备二氧化硫 | Na2SO3→SO2 | __________________ |
③ | 制备氯气 | HCl→Cl2 | __________________ |
(1)上述气体中从制备过程看,必须选择合适的氧化剂才能实现的是__________________(填气体的化学式,下同);从反应原理看,明显不同于其他两种气体的是__________________;
(2)根据表中所列实验原理,从下列装置中选择合适的气体发生装置,将其编号填入上表中的空格中。
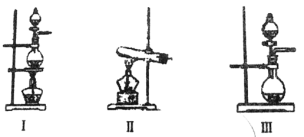
(3)某学习小组设计了如图实验,将氯气依次通过下列装置以验证氯气的性质:

①通入氯气后,A中的现象是__________________,整套实验装置存在的明显缺陷是__________________;
②C装置中发生反应的离子方程式为__________________。
③该小组同学欲设计一个实验,证明洗气瓶B中的Na2SO3己被氧化。具体操作为:取一定量的B中溶液于一洁净的试管中,向其中加入硝酸酸化的硝酸钡溶液后,若产生白色沉淀则证明已经被氧化。你认为__________________ (填“是”或“否”)合理?