题目内容
次磷酸钠(NaH2PO2)可用于化学镀镍,即通过化学反应在塑料镀件表面沉积镍—磷合金。
(1)化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性条件下发生以下镀镍反应:
① Ni2+ + H2PO2-+ → Ni + H2PO3-+
② 6H2PO2- +2H+ →2P+4H2PO3-+3H2↑
请配平反应式①。
(2)反应式①中还原剂是 ,被还原元素是 。
(3)反应②中,若生成1 mol H2PO3-,反应中转移电子的物质的量为 。
(4)从二个化学镀镍反应分析,若生成1mol Ni和1mol P,同时有 mol H2PO3-生成。
(5)完成下列各小题中的化学反应方程式:碱金属与O2反应生成氧化物较复杂,有普通氧化物(如K2O)过氧化物(如K2O2)还有超氧化物和臭氧化物等。要制备碱金属的普通氧化物一般是用碱金属还原对应的过氧化物、硝酸盐或亚硝酸盐。写出下列化学反应式:
①钠与过氧化钠反应
②钾还原硝酸钾还产生了一种单质气体
(1)化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性条件下发生以下镀镍反应:
① Ni2+ + H2PO2-+ → Ni + H2PO3-+
② 6H2PO2- +2H+ →2P+4H2PO3-+3H2↑

请配平反应式①。
(2)反应式①中还原剂是 ,被还原元素是 。
(3)反应②中,若生成1 mol H2PO3-,反应中转移电子的物质的量为 。
(4)从二个化学镀镍反应分析,若生成1mol Ni和1mol P,同时有 mol H2PO3-生成。
(5)完成下列各小题中的化学反应方程式:碱金属与O2反应生成氧化物较复杂,有普通氧化物(如K2O)过氧化物(如K2O2)还有超氧化物和臭氧化物等。要制备碱金属的普通氧化物一般是用碱金属还原对应的过氧化物、硝酸盐或亚硝酸盐。写出下列化学反应式:
①钠与过氧化钠反应
②钾还原硝酸钾还产生了一种单质气体
(1) 1,1,1 H2O,1,1,2H+;(2) H2PO2-,Ni(3) 2mol(4) 3
(5)①Na2O2+2Na=2Na2O;②2KNO3+10K=6K2O+N2(各2分)
(5)①Na2O2+2Na=2Na2O;②2KNO3+10K=6K2O+N2(各2分)
试题分析:(1)根据化合价升降相等:镍元素的化合价由+2价转化为0价,降低了2价,磷元素的化合价由+1价转化为+3价,升高的2价,再根据原子守恒和电荷守恒配平方程式;Ni2++H2PO2-+H2O═Ni+H2PO3 -+2H+,答案为:1,1,1 H2O,1,1,2H+;(2)反应式①:H2PO2-中磷元素的化合价由+1价转化为H2PO3-中的+3价,化合价升高,被氧化作还原剂;镍元素的化合价由+2价转化为0价,化合价降低被还原;(3)(4)由反应①知,生成1mol Ni同时生成1mol H2PO3-,由反应②知,生成1mol P,同时有2mol H2PO3-生成,所以生成1mol Ni和1mol P,同时有3mol H2PO3-生成(5)①根据题给信息知,钠与过氧化钠反应生成氧化钠,反应方程式为:Na2O2+2Na=2Na2O;②由题给信息知,钾与硝酸钾反应生成氧化钾,还产生一种单质气体,根据原子守恒,应为氮气,反应方程式为:2KNO3+10K=6K2O+N2。

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
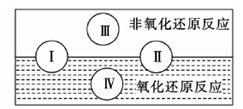
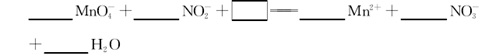
 xOH-+ N2+4H2O。下列有关说法正确的是
xOH-+ N2+4H2O。下列有关说法正确的是