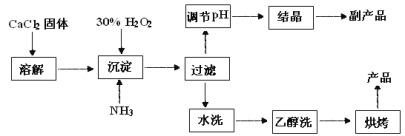
题目内容
【题目】下列说法中错误的是
A.根据对角线规则,铍和铝的性质具有相似性
B.在H3O+、NH4+ 和Cu(NH3)4]2+中都存在配位键
C.元素电负性越大的原子,吸引电子的能力越强
D.P4和CH4都是正四面体分子且键角都为109o28ˊ
【答案】D
【解析】
试题分析:根据对角线规则,铍和铝的性质具有相似性,故A正确;在H3O+、NH4+ 和Cu(NH3)4]2+中都存在配位键,故B正确;元素电负性越大的原子,吸引电子的能力越强,故C正确;P4分子键角都为60o,故D错误。

练习册系列答案
相关题目
【题目】化学在生产生活中有着广泛的应用,下列对应关系错误的是
选项 | 性质 | 实际应用 |
A | 蛋白质受热变性 | 用高温加热的方法杀死流感病毒 |
B | 明矾溶液显酸性 | 用明矾溶液清除铜镜表面的铜锈 |
C | Na2CO3溶液显碱性 | 用热的纯碱溶液洗去油污 |
D | P2O5具有吸水性 | 用P2O5干燥氨气 |
A. A B. B C. C D. D