题目内容
【题目】在已经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种,但与生产生活有密切的联系。
(1)为了提高煤的利用率,常将其气化为可燃性气体,主要反应是碳和水蒸气反应生成
水煤气,化学反应方程式为 。
(2)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反
应如下:N2(g)+3H2(g)![]() 2NH3(g)。
2NH3(g)。
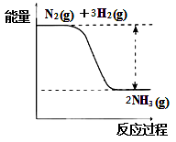
①合成氨的反应中的能量变化如右图所示。
该反应是 反应(填“吸热”或“放热”),其原因是反应物化学键断裂吸收的总能量 (填“大于”或“小于”)生成物化学键形成放出的总能量。
②在一定条件下,将一定量的N2和H2的混合气体充入某定容密闭容器中,一段时间后,下列叙述不能说明该反应达到平衡状态的是 (填序号)。
A.容器中混合气体的密度不随时间变化
B.单位时间内断裂3 mol H-H键的同时断裂6 mol N-H键
C. N2 、H2 、NH3的物质的量之比为1:3:2
D.容器中混合气体的平均相对分子质量不随时间变化
(3)目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)
+3H2(g)![]() CH3OH(g)+H2O(g),在体积为1 L的密闭容器中,充入1 molCO2和3 molH2,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g),在体积为1 L的密闭容器中,充入1 molCO2和3 molH2,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
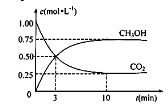
①从反应开始到平衡,用氢气浓度变化表示的平均反应速率v (H2)= 。
②达平衡时容器内平衡时与起始时的压强之比 。
【答案】(1)C(s)+H2O(g) ![]() CO (g)+ H2(g)
CO (g)+ H2(g)
(2)① 放热 小于 ② AC
(3) 0.225mol/(L.min); 5:8
【解析】
试题分析:(1)碳和水蒸气反应生成CO和H2,化学反应方程式为C(s)+H2O(g) ![]() CO (g)+ H2(g);(2)①合成氨的反应中生成物的总能量小于反应物的总能量,该反应是放热反应,其原因是反应物化学键断裂吸收的总能量小于生成物化学键形成放出的总能量。
CO (g)+ H2(g);(2)①合成氨的反应中生成物的总能量小于反应物的总能量,该反应是放热反应,其原因是反应物化学键断裂吸收的总能量小于生成物化学键形成放出的总能量。
②在一定条件下,将一定量的N2和H2的混合气体充入某定容密闭容器中,一段时间后,下列叙述不能说明该反应达到平衡状态的是AC。
A.根据![]() ,密度是恒量,容器中混合气体的密度不随时间变化,不一定平衡;
,密度是恒量,容器中混合气体的密度不随时间变化,不一定平衡;
B.单位时间内断裂3 mol H-H键的同时断裂6 mol N-H键,一定平衡;
C. N2 、H2 、NH3的物质的量之比为1:3:2,不一定平衡;
D.根据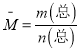 ,n(总)是变量,容器中混合气体的平均相对分子质量不随时间变化,一定平衡;
,n(总)是变量,容器中混合气体的平均相对分子质量不随时间变化,一定平衡;
(3) ①由图2可知,10min达平衡时甲醇的浓度变化量为0.75mol/L,所以v(CH3OH)=
![]() =0.075mol/(L·min),速率之比等于化学计量数之比,所以v(H2)=3v(CH3OH)=3×0.075mol/(L·min)=0.225mol/(L·min)。
=0.075mol/(L·min),速率之比等于化学计量数之比,所以v(H2)=3v(CH3OH)=3×0.075mol/(L·min)=0.225mol/(L·min)。
②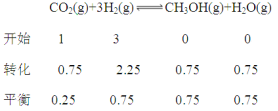
达平衡时容器内平衡时与起始时的压强之比(0.25+0.75+0.75 +0.75):4=5:8。

 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案