题目内容
据报道,锌-空气电池将会成为21世纪理想动力源.在碱性溶液中该电池总反应可表示为:2Zn+4NaOH+O2=2Na2ZnO2+2H2O,下列有关锌-空气电池说法正确的是( )
分析:根据电池反应式知,锌作负极,负极上电极反应式为:Zn+40H--2e-═ZnO22-+2H20,正极上通入空气,其电极反应式为O2+2H2O+4e-=4OH-,再结合Na2ZnO2和转移电子之间的关系、该电池特点、正极上的生成物来分析解答.
解答:解:A.锌作负极,负极上电极反应式为:Zn+40H--2e-═ZnO22-+2H20,故A正确;
B.根据电池反应式知,每生成1molNa2ZnO2转移电子的物质的量=1mol×(2-0)=2mol,故B错误;
C.Na2ZnO2是强碱弱酸盐,其溶液呈碱性,所以会对环境有污染,故C错误;
D.碱性条件下,正极上电极反应式为O2+2H2O+4e-=4OH-,酸性条件下,正极上电极反应式为O2+4H++4e-=2H2O,故D错误;
故选A.
B.根据电池反应式知,每生成1molNa2ZnO2转移电子的物质的量=1mol×(2-0)=2mol,故B错误;
C.Na2ZnO2是强碱弱酸盐,其溶液呈碱性,所以会对环境有污染,故C错误;
D.碱性条件下,正极上电极反应式为O2+2H2O+4e-=4OH-,酸性条件下,正极上电极反应式为O2+4H++4e-=2H2O,故D错误;
故选A.
点评:本题考查了原电池原理,会根据电池反应式中元素化合价变化来确定正负极上发生的电极反应,注意电极反应式的书写与电解质溶液的酸碱性有关,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 ,下列有关锌-空气电池说法正确的是
,下列有关锌-空气电池说法正确的是 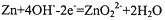
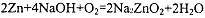 ,下列有关锌--空气电池说法正确的是
,下列有关锌--空气电池说法正确的是 转移4mol电子
转移4mol电子 