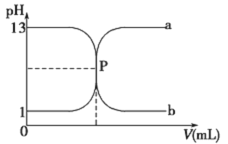
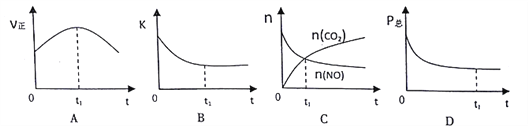
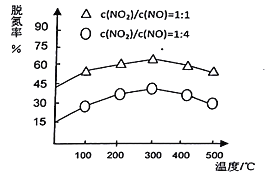
题目内容
【题目】如图1是部分短周期元素的常见化合价与原子序数的关系图: 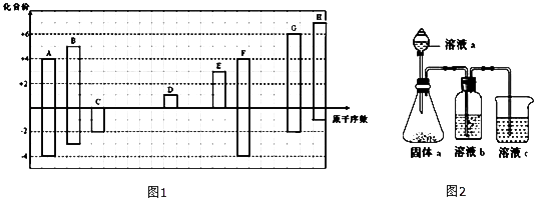
(1)元素F在周期表中的位置 .
(2)C与D形成原子个数比为1:1的化合物中所含化学键类型为 .
(3)C、D、G对应的简单离子半径由大到小顺序是 . (用离子符号回答)
(4)某同学设计实验装置如图2,证明A、B、F的非金属性强弱关系:
①溶液a和溶液b分别为 , .
②溶液c中的离子反应方程式为 .
【答案】
(1)第三周期ⅣA族
(2)离子键、非极性共价键
(3)S2﹣>O2﹣>Na+
(4)硝酸;饱和NaHCO3溶液;SiO32﹣+CO2+H2O=H2SiO3↓+CO32﹣或SiO32﹣+2CO2+2H2O=H2SiO3↓+2HCO3﹣
【解析】解:短周期元素中,A、F均有+4、﹣4价,处于ⅣA族,且原子序数A<F,故A为碳、F为Si;C、G均有﹣2价,且G有+6,G的原子序数较大,故C为O元素、G为S元素;B有+5、﹣3价,原子序数介于碳、氧之间,故B为N元素;H有+7、﹣1价,原子序数大于硫,则H为Cl;D有+1价,E有+3价,分别处于ⅠA族、ⅢA族,原子序数氧<D<E<Si,故D为Na,E为Al.
(1.)元素F为Si,在周期表中的位置:第三周期ⅣA族,所以答案是:第三周期ⅣA族;
(2.)O与Na形成原子个数比为1:1的化合物是过氧化钠,过氧化钠中所含有离子键、非极性共价键,所以答案是:离子键、非极性共价键;
(3.)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越小,简单离子半径大小顺序是:S2﹣>O2﹣>Na+ , 所以答案是:S2﹣>O2﹣>Na+;
(4.)利用最高价含氧酸的酸性强弱,证明A、B、F的非金属性强弱关系,溶液a为硝酸,溶液b为饱和NaHCO3溶液,溶液c为硅酸钠溶液,溶液c中的离子反应方程式为:SiO32﹣+CO2+H2O=H2SiO3↓+CO32﹣或SiO32﹣+2CO2+2H2O=H2SiO3↓+2HCO3﹣ ,
所以答案是:①硝酸;饱和NaHCO3溶液;②SiO32﹣+CO2+H2O=H2SiO3↓+CO32﹣或SiO32﹣+2CO2+2H2O=H2SiO3↓+2HCO3﹣ .