题目内容
【题目】一定温度下,向如图所示带有可移动活塞的密闭容器中充入2 L SO2 和1 L O2 的混合气体,发生如下反应2 SO2 (g) + O2 (g) ![]() 2 SO3 (g) 。
2 SO3 (g) 。

(1)若活塞可自由移动,平衡后,活塞停止在“2.1”处,则该反应中SO2 的转化率为_______。
(2)若使活塞固定在“3”处,向容器中充入4L SO2和2L O2,反应进行到某一时刻时, SO2和O2的转化率之比为 _____
(3)若使活塞固定在“3”处的三个相同容器,开始时,充入容器的起始物质分别是①2L SO2和1L O2 ;②2 L SO3 (g) 和 1 L N2 ;③1 L SO2 、1 L O2 和 1 L SO3 (g)。上述三种投料方式的反应体系均达到平衡后,则三种情况容器中SO3 (g)的物质的量浓度大小关系是__________(用序号和“<”、“=”、“>”表示)。
(4)向(1)平衡后的容器中充入0.2 mol 的SO3,活塞移动后再次达到平衡时,测得此过程中从外界共吸收了1.96 kJ 的热量。写出SO2 发生氧化反应的热化学方程式:__________________。
【答案】90% 1:1①=②<③2 SO2(g) + O2(g)![]() 2 SO3(g) △H= -196 kJ/mol
2 SO3(g) △H= -196 kJ/mol
【解析】
(1)若活塞可自由移动,平衡后,活塞停止在“2.1”处,表明平衡时混合气体为2.1L。
设参加反应被消耗的二氧化硫的体积为x。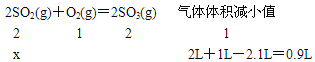
解得:x=1.8L该反应中SO2的转化率为1.8L/2.0L![]() 100
100![]() =90
=90![]()
(2)若使活塞固定在“3”处,属于恒容状态,在向容器中充入4L SO2和2L O2,是按反应计量数之比加入的反应物,无论反应进行到某一时刻, SO2和O2的转化率之比均为1:1。故答案为:1:1。
(3)在恒容的条件下,①和②两种方式最终达到的平衡是等效的;对于③,相当于充入2LSO2、1.5LO2,③和①相比,③中平衡正向移动的程度大于①,所以,③中SO3(g)的体积分数最大,所以,三种情况容器中SO3(g)的体积分数大小关系是①=②<③。
(4) 由于(1)中活塞可自由移动,向(1)平衡后的容器中充入0.2mol的SO3,活塞移动后再次达到平衡时,此时的平衡和原平衡是等效的,所以,0.2mol SO3中,有0.2mol×(1-90%)=0.02mol分解,吸收了1.96kJ的热量,则2mol SO3完全分解,需要吸收196kJ热量,2molSO2和1molO2完全反应,则会放出196kJ热量,所求热化学方程式为:2SO2(g)+O2(g)=2SO3(g) ΔH=-196kJmoL-1。