题目内容
硫代硫酸钠(Na2S2O3)可看成是一个S原子取代了NazS04中的一个O原子而
形成。某校化学研究性学习小组运用类比学习的思想,通过实验探究Na2S2O3的化学
性质。
【提出问题】Na2S2O3是否与Na2S2O4相似而具备下列性质呢?
猜想①:溶液呈中性,且不与酸反应;
猜想②:无还原性,不能被氧化剂氧化。
【实验探究】基于上述猜想①②,设计实验方案。
| 实验操作过程 | 实验现象或 预期实验现象 | 现象解释 (用离子方程式表示) | |
|
▲ |
溶液pH=8 |
| |
| 猜想① | 向Ph=2的硫酸中滴加 Na2S2O3溶液 | ▲ |
|
| 猜想② | 向新制氯水(pH<2)中滴 加少量Na2S2O3溶液 | 氯水颜色变浅 | ▲ |
【实验结论】Na2S2O3能与酸反应,具有还原性,与Na2S2O4的化学性质不相似。
【问题讨论】
(1)甲同学取探究“猜想②”反应后的溶液少量,滴加硝酸银溶液,观察到有白色沉淀并
据此认为氯水可将Na2S2O3氧化。你认为该方案是否合理并说明理由 ▲ 。
(2)若方案不合理,请你设计一个实验方案,证明Na2S2O3。被氯水氧化 ▲ 。
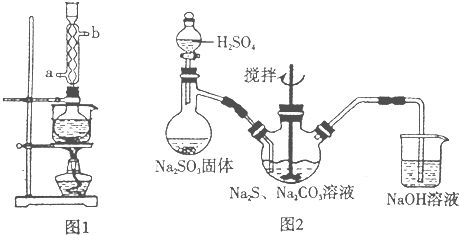
实验操作:把Na2S2O3溶于水,配成一定浓度溶液,把pH试纸置于干净的玻片,用玻璃棒蘸取溶液至pH试纸上,与标准比色卡对照,读出pH值
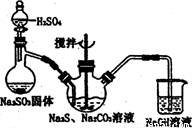
实验现象:有刺激性气味的气体生成,同时溶液中有淡黄色固体沉淀
离子方程式:S2O32—+ 4Cl2+5H2O=8 Cl—+ 2 SO42—+10H+
(1) 不合理,因为氯水过量,氯水中含有Cl—,无法证明AgCl沉淀中的Cl—来源
(2) 取少量反应后溶液,加入BaCl2溶液,若有白色沉淀,则说明S2O32—被氧化
解析:
本题考查验证性化学实验方案的设计以及实验现象、结论的表述。题目较易。基于实验目的,根据实验现象或结论很容易判断实验方案的设计目的及验证哪部分猜想。要求注意问题讨论中的细节,即(1)中猜想②的实验过程中滴加“少量”的Na2S2O3得出甲方案不合理的原因是过量氯水能提供Cl—,与Ag +产生白色沉淀,干扰性质验证,可变换试剂,用钡盐检测氧化产物SO42—。

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案