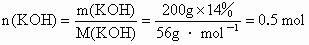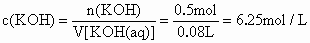题目内容
有一瓶质量分数为14%的KOH溶液,加热蒸发掉100g水后,得到28%的KOH溶液80mL.求所得溶液KOH的物质的量浓度.
答案:6.25mol/L#6.25摩尔/升
解析:
解析:
|
解:设原 KOH溶液的质量为x.由蒸发前后KOH质量不变,得:x ×14%=(x-100%)×28%,x=200g原 200g溶液与后80mL溶液含KOH物质的量相等,它为:
KOH 物质的量浓度为:
答: KOH物质的量浓度为6.25mol/L要对 80mL溶液求KOH的物质的量浓度,需要知道KOH的物质的量.在蒸发掉100g水的前后,KOH的量未变,KOH的质量分数由14%增至28%,那么原溶液的质量是多少呢?KOH的质量又是多少呢? |

练习册系列答案
相关题目