题目内容
(2011?四川模拟)某研究性学习小组用食盐、二氧化锰和浓硫酸共热反应制备氯气,并进行氯气性质实验.其中部分实验装置如图所示:
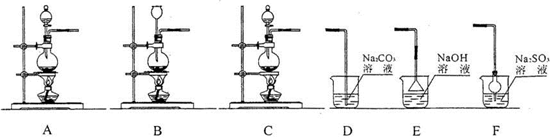
请填写下列空白:
(1)上图中,氯气制备装置正确的是
(2)在取用浓硫酸时,如果不慎将少量浓硫酸溅在手上,应立即采取的处置方法是:
(3)某同学做了两个实验:①将氯气通入到含有淀粉的碘水溶液中,蓝色消失(生成了碘酸).②停止通入氯气后向溶液中加入一定量的过氧化氢,又出现蓝色,并有气泡产生.请用化学方程式表示上述变化:
①
②
(4)实验完毕,可选用
A、氯化钠溶液 B、酸化的硫酸亚铁溶液 C、浓盐酸 D、酒精溶液.

请填写下列空白:
(1)上图中,氯气制备装置正确的是
A
A
,尾气处理装置正确的是DF
DF
.(填标号字母)(2)在取用浓硫酸时,如果不慎将少量浓硫酸溅在手上,应立即采取的处置方法是:
必须迅速用抹布擦试,再用大量的水冲洗,然后再涂上3%-5%的碳酸氢钠溶液
必须迅速用抹布擦试,再用大量的水冲洗,然后再涂上3%-5%的碳酸氢钠溶液
.(3)某同学做了两个实验:①将氯气通入到含有淀粉的碘水溶液中,蓝色消失(生成了碘酸).②停止通入氯气后向溶液中加入一定量的过氧化氢,又出现蓝色,并有气泡产生.请用化学方程式表示上述变化:
①
5Cl2+I2+6H2O=2HIO3+10HCl
5Cl2+I2+6H2O=2HIO3+10HCl
;②
2HIO3+5H2O2=I2+5O2↑+6H2O
2HIO3+5H2O2=I2+5O2↑+6H2O
.(4)实验完毕,可选用
BC
BC
(填标号字母)清洗附着在烧瓶内壁上的固体残留物.A、氯化钠溶液 B、酸化的硫酸亚铁溶液 C、浓盐酸 D、酒精溶液.
分析:(1)制备气体装置气密性要好,圆底烧瓶不能直接加热,需垫石棉网;
氯气有毒,不能直接排放到空气中,尾气经过吸收液,充分吸收,注意防止倒吸.
(2)浓硫酸有很强的腐蚀性,沾到了手上,应紧急处理,浓硫酸能与水混合会发热,如果用水清洗会增大烧伤面积,则先用抹布擦拭,再用大量的水冲洗,冲洗后皮肤上呈弱酸性,一般用弱碱性溶液来处理.
(3)①碘被氯气氧化生成了碘酸,溶液蓝色消失;
②碘酸氧化过氧化氢,生成碘和氧气,溶液又出现蓝色,并有气泡产生.
(4)烧瓶内壁上的固体残留物主要为二氧化锰,有强氧化性,能与还原性物质反应,能与浓盐酸.
氯气有毒,不能直接排放到空气中,尾气经过吸收液,充分吸收,注意防止倒吸.
(2)浓硫酸有很强的腐蚀性,沾到了手上,应紧急处理,浓硫酸能与水混合会发热,如果用水清洗会增大烧伤面积,则先用抹布擦拭,再用大量的水冲洗,冲洗后皮肤上呈弱酸性,一般用弱碱性溶液来处理.
(3)①碘被氯气氧化生成了碘酸,溶液蓝色消失;
②碘酸氧化过氧化氢,生成碘和氧气,溶液又出现蓝色,并有气泡产生.
(4)烧瓶内壁上的固体残留物主要为二氧化锰,有强氧化性,能与还原性物质反应,能与浓盐酸.
解答:解:(1)圆底烧瓶不能直接加热,需垫石棉网,装置气密性要好,结合发生装置,应该选择A装置;
氯气通入碳酸钠溶液,首先与水反应,且氯气再与水反应不剧烈,不需考虑倒吸,生成的盐酸再与碳酸钠反应,很好的吸收氯气,故D可以;
E装置中尾气直接排放空气中,故E不可;
氯气有强氧化性,亚硫酸钠有较强的还原性,氯气通入亚硫酸钠溶液,很好的吸收氯气,反应迅速,应考虑倒吸,故F可以.
故答案为:A;DF
(2)浓硫酸有很强的腐蚀性,沾到了手上,应紧急处理,具体处理方法:必须迅速用抹布擦试,再用大量的水冲洗,然后再涂上3%-5%的碳酸氢钠溶液;
故答案为:必须迅速用抹布擦试,再用大量的水冲洗,然后再涂上3%-5%的碳酸氢钠溶液
(3)①碘被氯气氧化生成了碘酸,溶液蓝色消失,反应方程式为5Cl2+I2+6H2O=2HIO3+10HCl
故答案为:5Cl2+I2+6H2O=2HIO3+10HCl
②碘酸氧化过氧化氢,生成碘和氧气,反应方程式为2HIO3+5H2O2=I2+5O2↑+6H2O,
故答案为:2HIO3+5H2O2=I2+5O2↑+6H2O
(4)烧瓶内壁上的固体残留物主要为二氧化锰,有强氧化性,能与还原性物质反应,能与浓盐酸.
故选BC
氯气通入碳酸钠溶液,首先与水反应,且氯气再与水反应不剧烈,不需考虑倒吸,生成的盐酸再与碳酸钠反应,很好的吸收氯气,故D可以;
E装置中尾气直接排放空气中,故E不可;
氯气有强氧化性,亚硫酸钠有较强的还原性,氯气通入亚硫酸钠溶液,很好的吸收氯气,反应迅速,应考虑倒吸,故F可以.
故答案为:A;DF
(2)浓硫酸有很强的腐蚀性,沾到了手上,应紧急处理,具体处理方法:必须迅速用抹布擦试,再用大量的水冲洗,然后再涂上3%-5%的碳酸氢钠溶液;
故答案为:必须迅速用抹布擦试,再用大量的水冲洗,然后再涂上3%-5%的碳酸氢钠溶液
(3)①碘被氯气氧化生成了碘酸,溶液蓝色消失,反应方程式为5Cl2+I2+6H2O=2HIO3+10HCl
故答案为:5Cl2+I2+6H2O=2HIO3+10HCl
②碘酸氧化过氧化氢,生成碘和氧气,反应方程式为2HIO3+5H2O2=I2+5O2↑+6H2O,
故答案为:2HIO3+5H2O2=I2+5O2↑+6H2O
(4)烧瓶内壁上的固体残留物主要为二氧化锰,有强氧化性,能与还原性物质反应,能与浓盐酸.
故选BC
点评:考查较为综合,题目难度中等,注意实验室制备气体的实验装置和反应原理,把握物质的主要性质,注重基础知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (2011?四川模拟)X、Y、Z是短周期元素,在周期表中的位置关系如图所示,下列说法不正确的是( )
(2011?四川模拟)X、Y、Z是短周期元素,在周期表中的位置关系如图所示,下列说法不正确的是( )