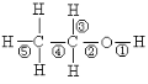
题目内容
【题目】按要求填空:
(1)原子核外有3个电子层,其价电子数为7的元素其最高价氧化物对应水化物化学式________,其单质与NaOH反应的化学方程式为____________________________________________________。
(2)已知X+、Y2+、Zˉ、W2ˉ四种离子均具有相同的电子层结构,则X、Y、Z、W这四种元素的原子序数由大到小的顺序是___________________,原子半径由大到小的顺序是__________________。
(3) A+、Bˉ、C、D 四种粒子(分子或离子),它们都分别含10个电子,已知它们有如下转化关系:A++Bˉ![]() C+D↑,则A+、Bˉ的电子式:_____________ ,______________;比较C和D的稳定性的强弱:_____________________(用化学式表示)。
C+D↑,则A+、Bˉ的电子式:_____________ ,______________;比较C和D的稳定性的强弱:_____________________(用化学式表示)。
(4)①NH4NO3 ②NaF ③CO2 ④K2O2 ⑤NaOH ⑥CH4
以上只含有极性键的是_______(填序号),既有离子键又有非极性键的是______(填序号);既有离子键又有极性键的是______(填序号)。
(5)下列原子:![]() 中共有____种元素,__种核素。
中共有____种元素,__种核素。
(6)写出下列物质或微粒的电子式:
①CO2__________②KCl_____________③H2O2_______________④N2_____________;
⑤用电子式表示MgCl2的形成过程_________________________________________________。
【答案】 HClO4 Cl2+2NaOH===NaClO+NaCl+H2O Y>X>Z>W X>Y>W>Z ![]()
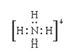 H2O>NH3 ③⑥ ④ ①⑤ 4 7
H2O>NH3 ③⑥ ④ ①⑤ 4 7 ![]()
![]()
![]() ④
④ ![]()
【解析】(1)原子核外有3个电子层,其价电子数为7,为Cl元素,最高价氧化物对应水化物为高氯酸,其化学式为HClO4,氯气与NaOH的反应为Cl2+2NaOH═NaClO+NaCl+H2O;
(2)具有相同的电子层结构的离子,阴前阳下,原子序数大的离子半径小,则X、Y、Z、W这四种元素的原子序数由大到小的顺序是Y>X>Z>W,原子半径由大到小的顺序是X>Y>W>Z;
(3)都分别含10个电子,由A++B-![]() C+D↑可知,铵根离子与氢氧根离子反应生成氨气和水,则A+、B-的电子式分别为
C+D↑可知,铵根离子与氢氧根离子反应生成氨气和水,则A+、B-的电子式分别为![]() ,非金属性越强,对应氢化物越稳定,则C和D的稳定性的强弱大小为H2O>NH3;
,非金属性越强,对应氢化物越稳定,则C和D的稳定性的强弱大小为H2O>NH3;
(4)①NH4NO3中含离子键、N-H和N-O极性键;②NaF只含离子键;③CO2中只含极性共价键;④K2O2中含离子键和O-O非极性键;⑤NaOH中含离子键和O-H极性键;⑥CH4中只含极性共价键;只含有极性键的是③⑥,既有离子键又有非极性键的是④;既有离子键又有极性键的是①⑤。
(5)元素的种类由质子数决定,质子数不同,元素的种类就不同,![]() 质子数相同为同种元素,
质子数相同为同种元素,![]()
![]() 质子数相同为同种元素,
质子数相同为同种元素,![]()
![]() 质子数相同为同种元素,
质子数相同为同种元素,![]() 属于钠元素,则共有4种元素;核素是指具有一定数目质子和一定数目中子的一种原子,
属于钠元素,则共有4种元素;核素是指具有一定数目质子和一定数目中子的一种原子,![]() 中具有一定质子数和一定中子数的原子为7种核素;
中具有一定质子数和一定中子数的原子为7种核素;
(6)①二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为![]() ;
;
②KCl为离子化合物,由K+和Cl-构成,电子式为![]() ;③双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为
;③双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为![]() ;④氮气分子中存在1个氮氮三键,氮气的电子式为:
;④氮气分子中存在1个氮氮三键,氮气的电子式为:![]() ;⑤MgCl2属于离子化合物,Mg最外层两个电子被两个Cl原子得到,用电子式表示形成过程为:
;⑤MgCl2属于离子化合物,Mg最外层两个电子被两个Cl原子得到,用电子式表示形成过程为:![]() 。
。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案