题目内容
【题目】一种熔融碳酸盐燃料电池工作原理如图所示.则下列推断错误的是( )
A.放电时负极有CO2生成
B.正极反应为O2+2CO2+4e﹣═2CO32﹣
C.反应CH4+H2O ![]() 3H2+CO,每消耗1molCH4转移6mol 电子
3H2+CO,每消耗1molCH4转移6mol 电子
D.该电池可在常温或高温时进行工作,对环境具有较强的适应性
【答案】D
【解析】A.负极上CO和H2被氧化生成二氧化碳和水,电极A反应为:H2+CO+2CO32﹣﹣4e﹣=H2O+3CO2 , 有二氧化碳生成,故A正确;
B.正极为氧气得电子生成CO32﹣ , 反应为O2+2CO2+4e﹣=2CO32﹣ , 故B正确;
C.反应CH4+H2O ![]() 3H2+CO,反应中C元素化合价由﹣4价升高到+2价,每消耗1molCH4转移6mol 电子,故C正确;
3H2+CO,反应中C元素化合价由﹣4价升高到+2价,每消耗1molCH4转移6mol 电子,故C正确;
D.熔融碳酸盐为电解质,应在高温下进行工作,常温下不能形成原电池,故D错误.
故选D.

【题目】氮的氧化物(如NO2、NO4、N2O5等)应用很广,在一定条件下可以相互转化.
(1)从N2O5可通过电解或臭氧氧化N2O4的方法制备.电解装置如图1所示(隔膜用于阻止水分子通过),其阳极反应式为 .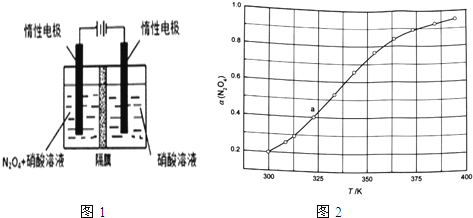
己知:2NO(g)+O2(g)═2NO2(g)△H1
NO(g)+O3(g)═NO2(g)+O2(g)△H2
2NO2(g)N2O4(g)△H3
2N2O5(g)═4NO2(g)+O2(g)△H4
则反应N2O4(g)+O3(g)═N2O5(g)+O2(g)的△H= .
(2)从N2O5在一定条件下发生分解:2N2O5(g)═4NO2(g)+O2(g).某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
c(N2O5)/mol/L | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
设反应开始时体系压强为P0 , 第2.00min时体系压强为p,则p:p0= ;
1.00~3.00min内,O2的平均反应速率为 .
(3)从N2O4与NO2之间存在反应N2O42NO2(g).将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度变化如图1所示.
①图中a点对应温度下,已知N2O4的起始压强p0为108kPa,列式计算该温度下反应的平衡常数Kp= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
②由图推测N2O4(g)2NO2(g)是吸热反应还是放热反应,说明理由 ,若要提高N2O4转化率,除改变反应温度外,其他措施有 (要求写出两条).
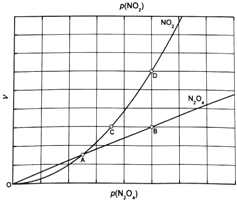
③对于反应N2O4(g)2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1p(N2O4),v(NO2)=k2[p(NO2)]2 . 其中,kl、k2是与反应及温度有关的常数.相应的速率一压强关系如图所示:一定温度下,kl、k2与平衡常数Kp的关系是kl= ,在图标出的点中,指出能表示反应达到平衡状态的点并说明理由 .