题目内容
【题目】研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题。
(1)CO可用于合成甲醇。在压强为0.1 MPa条件下,在体积为b L的密闭容器中充入a mol CO和2a mol H2,在催化剂作用下合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
平衡时CO的转化率与温度、压强的关系如下图:
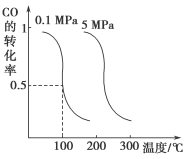
(ⅰ)该反应属于___________反应(填“吸热”或“放热”)。
(ⅱ)100 ℃时,若一个可逆反应的平衡常数K值很大,对此反应的说法正确的是___________(填序号)。
a.该反应使用催化剂意义不大
b.该反应发生将在很短的时间内完成
c.该反应达到平衡时至少有一种反应物百分含量很小
d.该反应一定是放热反应
(ⅲ)在温度和容积不变的情况下,再向平衡体系中充入a mol CO、2a mol H2,达到平衡时CO的转化率___________(填“增大”、“不变”或“减小”,下同),平衡常数___________。
(ⅳ)在某温度下,向一容积不变的密闭容器中充入2.5 mol CO、7.5 mol H2,反应生成CH3OH(g)达到平衡时,CO的转化率为90%,此时容器内压强为开始时压强的___________倍。
(2)某温度下,若将CO2(g)和H2(g)以体积比1∶4混合,在适当压强和催化剂作用下可制得甲烷,已知:
CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
H2(g)+1/2O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
则CO2(g)和H2(g)反应生成甲烷和液态水的热化学方程式为____________________。
【答案】(1)(ⅰ)放热 ;(ⅱ) c; (ⅲ)增大,不变 ;(ⅳ)0.55;
(2)CO2(g)+4H2(g)===CH4(g)+2H2O(l) ΔH=-252.9 kJ·mol-1。
【解析】
试题分析:(1)(i)根据图像,随着温度的升高,CO的转化率降低,说明反应向逆反应方向进行,根据勒夏特列原理,正反应方向是放热反应;(ii)a、通常状况下,有可能不反应,使用催化剂才能反应,故错误;b、短时间完成,说明反应速率快,化学平衡常数跟化学平衡有关,故错误;c、反应平衡常数很大,说明反应进行程度很大,反应达到平衡,反应物至少有一种反应物百分含量很小,故正确;d、化学平衡常数只受温度影响,100℃时化学平衡常数很大,说明升高温度,平衡向正反应方向移动,即为吸热反应,故错误;(iii)相当于在原来的基础上增大压强,增大压强平衡向正反应方向移动,CO的转化率增大,但平衡常数不变,因为它只受温度的影响;(iv)压强之比等于物质的量之比,消耗1molCO,物质的量减少2mol,减少CO:2.5×90%mol=2.25mol,物质的量减少2×2.25mol=4.5mol,则反应后总物质的量为(10-4.5)mol=5.5mol,反应后的压强是反应压强的0.55倍;(2)①CH4(g)+2O2(g)=CO2(g)+2H2O(l),②H2(g)+1/2O2(g)=H2O(l) ,4×②-①得出△H=(4×-285.8+890.3)kJ·mol-1=-252.9kJ·mol-1,CO2(g)+4H2(g)===CH4(g)+2H2O(l) ΔH=-252.9 kJ·mol-1。

 阅读快车系列答案
阅读快车系列答案