题目内容
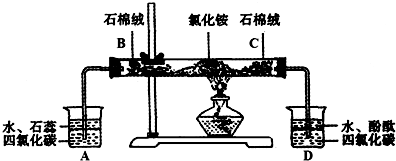
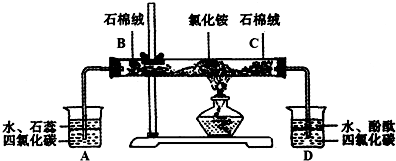
可用如下装置来演示NH4Cl受热分解实验:
试回答下列问题:
(1)点燃酒精灯之前应进行何种操作 .
(2)c处混入石棉绒的药品是 ;其作用为 .
(3)装置A、D中使用四氯化碳的目的是 .
(4)B处混入石棉绒中的试剂应选用 (填字母序号).
A.NaOH B.CuSO4 C.H2SO4 D.P2O5
(5)通过什么现象可说明NH4Cl受热分解生成了HCl和NH3 .
解答:解:(1)任何有仪器连接的实验装置在实验前都应检查装置的气密性,故答案为:检查装置气密性;
(2)D装置的目的是检验氨气,所以要排除氯化氢的干扰;氯化氢是酸性气体,所以要用碱性物质吸收,常用碱式吸收酸性气体的试剂为碱石灰,
故答案为:碱石灰;吸收NH4Cl受热分解产生的HCl;
(3)氯化氢和氨气都极易溶于水,容易产生倒吸,但不溶于四氯化碳,所以四氯化碳的作用是防止倒吸,故答案为:防止倒吸;
(4)A装置的目的是检验氯化氢,所以要排除氨气的干扰;氨气是碱性气体,所以要用酸性物质吸收,且B处放置的是固体,故选D;
(5)氨气是有刺激性气味的碱性气体,所以要用无色的酚酞溶液检验,氨气使无色的酚酞试液变红;氯化氢是酸性气体,所以要用紫色石蕊试液检验,氯化氢能使石蕊试液变红,
故答案为:A中石蕊变红且不褪色说明生成了HCl;D中酚酞变红说明生成了NH3.
点评:本题考查了氯化铵、氨气、氯化氢的性质,难度不大,注意除杂试剂的选择,原则是:酸性气体用碱性试剂,碱性气体用酸性试剂.

(12分)工业上可用下列装置来测定黄铁矿中硫的质量分数(忽略SO2、H2SO3与氧气的反应)
实验的正确操作步骤如下:
A.连接好装置,并检查装置的气密性
B.称取研细的黄铁矿样品
C.将2.0g样品小心地放入硬质玻璃管中
D.以1L/min的速率鼓入空气
E.将硬质玻璃管中的黄硫铁矿样品加热到800℃~850℃
F.用300mL的饱和碘水吸收SO2,发生的反应是:I2+SO2+2H2O=2HI+H2SO4
G.吸收液用CCl4萃取,分液
H.取20.00mL吸收液,用标准0.2000mol·L-1的NaOH溶液滴定。
试回答:
(1)已知:4FeS2 + 11 O2 = 2Fe2O3+8SO2 如12gFeS2完全燃烧放热85.3kJ,则FeS2燃烧热的热化学方程式是 。
(2)步骤G中所用主要仪器是 ,应取 (填“上”或“下” )层溶液进行后续实验。
(3)装置①的作用是 。
(4)步骤H中滴定时应选用 作指示剂
(5)假定黄硫铁矿中的硫在操作E中已全部转化为SO2,并且被饱和碘水完全吸收。滴定得到的数据如表所示:
| 滴定次数 | 待测液体的体积/mL | 标准碱溶液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 第一次 | 20.00mL | 0.00 | 20.58 |
| 第二次 | 20.00mL | 0.22 | 20.20 |
| 第三次 | 20.00mL | 0.36 | 20.38 |
则硫铁矿样品中硫元素的质量分数为 (保留小数点后1位)
(6)也有人提出用“沉淀质量法”测定黄铁矿中含硫质量分数,若用这种方法测定,最好是在装置⑤所得吸收液中加入下列哪种试剂 。
A.硝酸银溶液 B.氯化钡溶液 C.澄清石灰水 D.酸性高锰酸钾溶液
(12分)工业上可用下列装置来测定黄铁矿中硫的质量分数(忽略SO2、H2SO3与氧气的反应)

实验的正确操作步骤如下:
A.连接好装置,并检查装置的气密性
B.称取研细的黄铁矿样品
C.将2.0g样品小心地放入硬质玻璃管中
D.以1L/min的速率鼓入空气
E.将硬质玻璃管中的黄硫铁矿样品加热到800℃~850℃
F.用300mL的饱和碘水吸收SO2,发生的反应是:I2+SO2+2H2O=2HI+H2SO4
G.吸收液用CCl4萃取,分液
H.取20.00mL吸收液,用标准0.2000mol·L-1的NaOH溶液滴定。
试回答:
(1)已知:4FeS2 + 11 O2 = 2Fe2O3+ 8SO2 如12gFeS2完全燃烧放热85.3kJ,则FeS2燃烧热的热化学方程式是 。
(2)步骤G中所用主要仪器是 ,应取 (填“上”或“下” )层溶液进行后续实验。
(3)装置①的作用是 。
(4)步骤H中滴定时应选用 作指示剂
(5)假定黄硫铁矿中的硫在操作E中已全部转化为SO2,并且被饱和碘水完全吸收。滴定得到的数据如表所示:
|
滴定次数 |
待测液体的体积/mL |
标准碱溶液的体积/mL |
|
|
滴定前 |
滴定后 |
||
|
第一次 |
20.00mL |
0.00 |
20.58 |
|
第二次 |
20.00mL |
0.22 |
20.20 |
|
第三次 |
20.00mL |
0.36 |
20.38 |
则硫铁矿样品中硫元素的质量分数为 (保留小数点后1位)
(6)也有人提出用“沉淀质量法”测定黄铁矿中含硫质量分数,若用这种方法测定,最好是在装置⑤所得吸收液中加入下列哪种试剂 。
A.硝酸银溶液 B.氯化钡溶液 C.澄清石灰水 D.酸性高锰酸钾溶液