题目内容
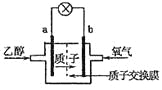
【题目】碲是ⅥA 族元素,其单质和化合物在化工生产等方面具有广泛地应用。
(1)TeO2 是两性氧化物,微溶于水,可溶于强酸或强碱。TeO2 和足量 NaOH 溶液发生反应的离子方程式为_____。
(2)从粗铜精炼的阳极泥(主要含有 Cu2Te)中提取粗碲的一种工艺流程如图:
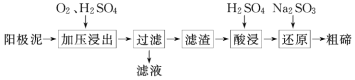
①已知加压酸浸时控制溶液的 pH 为 5.0,生成 TeO2 沉淀。如果 H2SO4 溶液浓度过大,产生 的后果是______________________________________________。
②对滤渣“酸浸”后,将 Na2SO3 加入 Te(SO4)2 溶液中进行“还原”得到固态碲,该反应的离子 方程式是______________________________________________。
③“还原”得到固态碲后分离出粗碲后,对粗碲进行洗涤,判断洗涤干净的实验操作和现象是_____。
(3)已知阳极泥中 Cu2Te 的含量为 a%,则 m 吨阳极泥理论上可制得纯度为 n%的粗碲_____ 吨。
【答案】TeO2+2OH-===TeO32-+H2O TeO2 会继续与酸反应,导致 TeO2 沉淀不完全 2SO42-+Te4++2H2O===Te↓+2SO42-+4H+ 取少量最后一次洗涤液,加入 BaCl2 溶液,若没有白色沉淀生成,则说明洗涤干净 ma/2n
【解析】
TeO2微溶于水,易溶于较浓的强酸和强碱。工业上常用铜阳极泥(主要含有 Cu2Te)为原料制备单质碲,加入氢氧化钠TeO2溶解,过滤得到滤渣为不溶于碱的物质,滤液中加入硫酸沉碲过滤得到TeO2,对滤渣“酸浸”后,将 Na2SO3 加入 Te(SO4)2 溶液中进行“还原”得到固态碲。
(1)TeO2是两性氧化物,和NaOH溶液反应生成盐Na2TeO3和水,发生反应的离子方程式为TeO2+2OH-=TeO32-+H2O;
(3)①TeO2具有两性,如果溶液酸性过强,TeO2会继续与酸反应,导致TeO2沉淀不完全;
②Na2SO3加入Te(SO4)2溶液中进行“还原”得到固态碲,同时生成Na2SO4,该反应的离子方程式是 2SO42-+Te4++2H2O===Te↓+2SO42-+4H+;
③通过过滤从反应后的混合液中获得粗碲,粗碲表面附着的离子中含有SO42-,因此判断洗涤干净的实验操作和现象是取少量最后一次洗涤液,加入BaCl2溶液,若没有白色沉淀生成,则说明洗涤干净;
(3)已知阳极泥中 Cu2Te 的含量为 a%,则 m 吨阳极泥理论上可制得纯度为 n%的粗碲![]() 吨。
吨。