题目内容
【题目】滴定实验是化学学科中重要的定量实验。
已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下实验:
①称量1.0g样品溶于水,配成250 mL溶液;
②准确量取25.00mL所配溶液于锥形瓶中;
③滴加几滴酚酞溶液;
④用0.1000mol/L的标准盐酸滴定三次,每次消耗盐酸的体积记录如下:
滴定序号 | 待测液体积(mL) | 所消耗标准盐酸的体积(mL) | |
滴定前 | 滴定后 | ||
1 | 25.00 | 0.50 | 20.60 |
2 | 25.00 | 6.00 | 26.00 |
3 | 25.00 | 1.10 | 21.00 |
请回答下列问题:
(1)滴定终点时的现象是_______________________________________。
(2)所配制的250 mL样品液中NaOH的物质的量浓度是_________ mol·L-1;试样中NaOH的质量分数为__________________。
(3)若出现下列情况,测定结果偏高的是___________。
a.滴定前用蒸馏水冲洗锥形瓶
b.在摇动锥形瓶时不慎将瓶内溶液溅出
c.滴定前有气泡,滴定后气泡消失
d.酸式滴定管滴至终点对,俯视读数
e.酸式滴定管用蒸馏水洗后,未用标准液润洗
【答案】 浅红色变为无色,30s不变色 0.08 80% c e
【解析】(1)滴加几滴酚酞的NaOH溶液显红色,当滴定到终点时,溶液显中性,溶液变为无色;故答案为:浅红色变为无色,30s不变色;(2)用0.10mol/L的标准盐酸滴定三次,消耗盐酸的平均体积为![]() mL=20.00mL,
mL=20.00mL,
HCl~~~~~~~~~~~~~~~~~~~~~~~NaOH
1 1
0.10mol/L×20mL n(NaOH),
解之得n(NaOH)=0.002mol,所以物质的量浓度为: ![]() =0.08mol/L,则烧碱样品的纯度为
=0.08mol/L,则烧碱样品的纯度为![]() =80%;(3)a.滴定前用蒸馏水冲洗锥形瓶,结果无影响;b.在振荡锥形瓶时不慎将瓶内溶液溅出,结果偏低;c.滴定前,滴定管尖嘴部分有气泡,滴定后气泡消失,NaOH溶液体积偏多,根据c(待测)=
=80%;(3)a.滴定前用蒸馏水冲洗锥形瓶,结果无影响;b.在振荡锥形瓶时不慎将瓶内溶液溅出,结果偏低;c.滴定前,滴定管尖嘴部分有气泡,滴定后气泡消失,NaOH溶液体积偏多,根据c(待测)=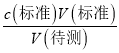 ,所以c(待测)偏高;d.酸式滴定管滴至终点对,俯视读数,盐酸读数偏小,结果偏低;e.酸式滴定管用蒸馏水洗后,未用标准液润洗,需要更多的盐酸,结果偏高;答案选ce。
,所以c(待测)偏高;d.酸式滴定管滴至终点对,俯视读数,盐酸读数偏小,结果偏低;e.酸式滴定管用蒸馏水洗后,未用标准液润洗,需要更多的盐酸,结果偏高;答案选ce。