题目内容
在反应中:Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O
(1)
(2)Cu发生了
(3)用双线桥标出反应的电子转移方向和数目:Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O,若有1.5molCu发生了反应,则转移的电子的个数是
(1)
S
S
元素被还原;H2SO4
H2SO4
是氧化剂(填元素符号或化学式)(2)Cu发生了
氧化
氧化
反应;若某元素的化合价升高了,则该元素所在的生成物称为氧化产物,该反应的还原产物是SO2
SO2
.(填元素符号或化学式)(3)用双线桥标出反应的电子转移方向和数目:Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O,若有1.5molCu发生了反应,则转移的电子的个数是
3NA
3NA
.分析:(1)氧化还原反应中元素化合价升高的物质失去电子做还原剂,被氧化为氧化产物;元素化合价降低的物质得到电子做氧化剂被还原得到还原产物;
(2)氧化还原反应中元素化合价升高的物质失去电子做还原剂,被氧化为氧化产物;元素化合价降低的物质得到电子做氧化剂被还原得到还原产物;
(3)该氧化还原反应中,得电子的元素是硫,化合价降低2价,失电子的元素是铜,化合价升高2价,所以转移电子2mol.
(2)氧化还原反应中元素化合价升高的物质失去电子做还原剂,被氧化为氧化产物;元素化合价降低的物质得到电子做氧化剂被还原得到还原产物;
(3)该氧化还原反应中,得电子的元素是硫,化合价降低2价,失电子的元素是铜,化合价升高2价,所以转移电子2mol.
解答:解:(1)Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O,反应中硫元素化合价从+6价变化为+4价,化合价降低做氧化剂,硫元素被还原,
故答案为:S;H2SO4;
(2)氧化还原反应中铜元素化合价升高,失去电子做还原剂,被氧化为氧化产物;硫元素化合价降低,硫酸得到电子做氧化剂,被还原得到还原产物SO2,
故答案为:氧化;SO2;
(3)氧化还原反应中,得电子的元素是硫,化合价降低2价,失电子的元素是铜,化合价升高2价,所以转移电子2mol;表示方法为: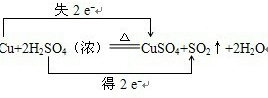 ;
;
若有1.5molCu发生了反应,依据电子转移故选计算:Cu~Cu2+~2e-;则转移的电子的个数是3NA;
故答案为: ;3NA.
;3NA.
故答案为:S;H2SO4;
(2)氧化还原反应中铜元素化合价升高,失去电子做还原剂,被氧化为氧化产物;硫元素化合价降低,硫酸得到电子做氧化剂,被还原得到还原产物SO2,
故答案为:氧化;SO2;
(3)氧化还原反应中,得电子的元素是硫,化合价降低2价,失电子的元素是铜,化合价升高2价,所以转移电子2mol;表示方法为:
 ;
;若有1.5molCu发生了反应,依据电子转移故选计算:Cu~Cu2+~2e-;则转移的电子的个数是3NA;
故答案为:
 ;3NA.
;3NA.点评:本题考查氧化还原反应中的概念分析判断,反应电子转移情况以及关于方程式的计算知识,可以根据所学知识进行回答,难度不大.

练习册系列答案
相关题目