题目内容
已知298 K时,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,推测含1 mol HCl的稀溶液与含1 mol NH3的稀溶液反应放出的热量 ( )
A.大于57.3 kJ B.等于57.3 kJ
C.小于57.3 kJ D.无法确定
【答案】
C
【解析】
试题分析:由于NH3·H2O是弱碱,一部分电离,电离要吸热,故1 mol NH3与1 mol HCl在稀溶液中反应时放出的热量小于57.3 kJ。
考点:本题考查了反应热的求算。

练习册系列答案
相关题目
 2NH3(g);已知298 K时,
2NH3(g);已知298 K时,

 2B(g) ΔH=-a kJ·mol-1。其中B的物质的量浓度随时间变化如图所示。
2B(g) ΔH=-a kJ·mol-1。其中B的物质的量浓度随时间变化如图所示。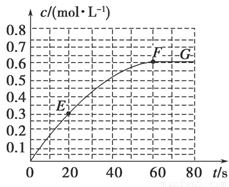
 2NH3(g);已知298 K时,
2NH3(g);已知298 K时,
