题目内容
等质量的D2O和H2O所含的中子数之比为 ,电子数之比为 ;等物质的量的D2O和H2O分别与足量的金属钠反应,放出的氢气的质量比为 ,转移电子数之比为 .
【答案】分析:根据n=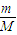 计算D2O和H2O的物质的量,再利用分子的构成、原子的构成来计算中子数之比、电子数之比;等物质的量的D2O和H2O分别与足量的金属钠反应,则有2Na~H2↑,以此来计算氢气的质量关系及转移的电子数之比.
计算D2O和H2O的物质的量,再利用分子的构成、原子的构成来计算中子数之比、电子数之比;等物质的量的D2O和H2O分别与足量的金属钠反应,则有2Na~H2↑,以此来计算氢气的质量关系及转移的电子数之比.
解答:解:设D2O和H2O的质量都是18g,
则n(H2O)= =1mol,
=1mol,
n(D2O)= =
= mol,
mol,
则等质量的D2O和H2O所含的中子数之比为 mol×(1×2+8):1mol×8=9:8,
mol×(1×2+8):1mol×8=9:8,
电子数之比为 mol×(1×2+8):1mol×(1×2+8)=9:10;
mol×(1×2+8):1mol×(1×2+8)=9:10;
等物质的量的D2O和H2O分别与足量的金属钠反应,
由2Na~2D2O~D2↑,2Na~2H2O~H2↑,
则放出的氢气的质量比为1mol×4g/mol:1mol×2g/mol=2:1,
产生等物质的量的氢气,氢元素的化合价都是由+1价降低为0,
则转移的电子数相等,即转移电子数之比为1:1,
故答案为:9:8;9:10;2:1;1:1.
点评:本题考查物质的量的计算,明确质量、物质的量的关系,H、D的原子构成及Na与水的反应是学生解答本题的关键,难度不大.
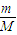 计算D2O和H2O的物质的量,再利用分子的构成、原子的构成来计算中子数之比、电子数之比;等物质的量的D2O和H2O分别与足量的金属钠反应,则有2Na~H2↑,以此来计算氢气的质量关系及转移的电子数之比.
计算D2O和H2O的物质的量,再利用分子的构成、原子的构成来计算中子数之比、电子数之比;等物质的量的D2O和H2O分别与足量的金属钠反应,则有2Na~H2↑,以此来计算氢气的质量关系及转移的电子数之比.解答:解:设D2O和H2O的质量都是18g,
则n(H2O)=
 =1mol,
=1mol,n(D2O)=
 =
= mol,
mol,则等质量的D2O和H2O所含的中子数之比为
 mol×(1×2+8):1mol×8=9:8,
mol×(1×2+8):1mol×8=9:8,电子数之比为
 mol×(1×2+8):1mol×(1×2+8)=9:10;
mol×(1×2+8):1mol×(1×2+8)=9:10;等物质的量的D2O和H2O分别与足量的金属钠反应,
由2Na~2D2O~D2↑,2Na~2H2O~H2↑,
则放出的氢气的质量比为1mol×4g/mol:1mol×2g/mol=2:1,
产生等物质的量的氢气,氢元素的化合价都是由+1价降低为0,
则转移的电子数相等,即转移电子数之比为1:1,
故答案为:9:8;9:10;2:1;1:1.
点评:本题考查物质的量的计算,明确质量、物质的量的关系,H、D的原子构成及Na与水的反应是学生解答本题的关键,难度不大.

练习册系列答案
相关题目
 ,电子数之比是
,电子数之比是 。等物质的
。等物质的