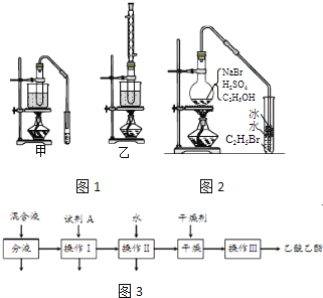
��Ŀ����
����Ŀ����ҵ�û�ͭ����Ҫ�ɷ�CuFeS2��������п��Ǧ�����ұ��ͭ��һ�ַ������£�
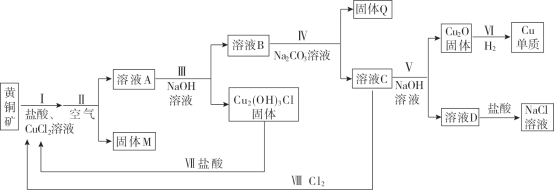
��1�����з������з�Ӧ����.CuFeS2 + 3Cu2+ + 4Cl- = 4CuCl+ Fe2+ +2S��. CuCl + Cl-![]() CuCl2-��I�������������________��
CuCl2-��I�������������________��
��2������ͨ���������Fe2+ת��FeOOH������
��Fe2+ת��ΪFeOOH�����ӷ���ʽ��__________��
����ҺA�к�����Ԫ�ص������У�Zn2+��Pb2+��________��
��3�����������NaOH��Һ����������ԭ����________��
��4�����м���Na2CO3��Һ��Ŀ����________��
��5��V�з�Ӧ�����ӷ���ʽ��________��
��6��������ѭ�����õĽǶȷ�������δ���NaCl��Һ���ܸ��õط����ڸ�ұ��ͭ�Ĺ��գ���˵�����ɣ�__��
���𰸡�����Cl-���ٽ�I�з�Ӧ�����ͭԪ�ؽ����� 4Fe2+ + O2 + 6H2O = 4FeOOH��+ 8H+ Cu2+��CuCl2- ��ֹZn2+��Pb2+������ͬʱ����CuCl2-���Cu2O���� ��ȥZn2+��Pb2+ 2CuCl2- + 2OH- = Cu2O��+4Cl- +H2O ����Ȼ�����Һ����H2��Cl2��NaOH��NaOH������������������������H2������������ԭ����Cl2�����ڢ���������
��������
��1���۲�I�е�������Ӧ������ii�ǿ��淴Ӧ����ʹ��ϡ������Դ�ʹƽ�������ƶ�������ͭԪ�صĽ����ʣ�
��2����Fe2+��O2����FeOOH����Ӧ���л�����H2O������д������ʽ��
�ڸ���I�еķ�Ӧ��Cu(OH)3Cl�������Ƴ���ҺA�л�����Cu2+��CuCl2-��
��3���������У�����ҺA�еõ���Cu(OH)3ClҪ��������Ĵ����õ�CuCl2�����Ҫ��Cu(OH)3Cl�Ĵ���Ҫ�ߣ�����III�п���NaOH��������Ϊ�˷�ֹZn2+��Pb2+�γɳ�����ͬʱҲ�ɱ���CuCl2-���Cu2O������
��4��ͨ��V��VI��֪����ҺC��û���������ӣ��ʢ��м���Na2CO3��Һ��Ϊ�˳�ȥZn2+��Pb2+��
��5����ҺC�е���Ҫ����ΪCuCl2-������ͼ�п�֪�������Ӻ�NaOH��Ӧ������Cu2O���ݴ�д�����ӷ���ʽ��
��6���۲�����ͼ�����Է��ֵ�ⱥ��NaCl��Һ���õIJ���Cl2��H2��NaOH�������ã��ʿ��Ե���Ȼ�����Һ��
��1��ʹ��ϡ���ᣬ��������Cl-��Ũ�ȣ�ʹ�÷�Ӧii��ƽ�������ƶ�������ͭԪ�صĽ����ʣ�
��2����Fe2+ת��ΪFeOOH�����ӷ���ʽΪ4Fe2++O2+6H2O=4FeOOH��+8H+��
�ڻ�ͭ���CuCl2��ϡ���ᷴӦ������������Һͨ��O2�õ���ҺA�������Ƴ���Һ����CuCl2-���ٸ�����ҺA�м���NaOH��Һ�õ�Cu(OH)3Cl�������Ƴ���ҺA�л�����Cu2+��
��3��III�п���NaOH��������Ϊ�˷�ֹZn2+��Pb2+�γɳ�����ͬʱҲ�ɱ���CuCl2-���Cu2O�������Է�ֹCu(OH)3Cl�к������ʣ�
��4�����м���Na2CO3��Һ��Ϊ�˳�ȥZn2+��Pb2+��
��5����ҺC�е���Ҫ����ΪCuCl2-������ͼ�п�֪�������Ӻ�NaOH��Ӧ������Cu2O����Ӧ�����ӷ���ʽΪ��2CuCl2-+2OH-=Cu2O��+4Cl- +H2O��
��6����ͼ��ʾ������Ȼ�����Һ����H2��Cl2��NaOH��NaOH�����ڢ�������������H2�����ڢ�����ԭ����Cl2�����ڢ�����������

 ���ĺ����Ͼ�������ϵ�д�
���ĺ����Ͼ�������ϵ�д�