题目内容
 (I)在铝热反应 Fe2O3+2Al
(I)在铝热反应 Fe2O3+2Al
| ||
Fe2O3
Fe2O3
(填化学式),作为还原剂的物质是Al
Al
(填化学式);(II)Zn粒和稀盐酸反应一段时间后,反应速率会减慢,当加热或加入浓盐酸后,反应速率明显加快.由此判断,影响化学反应速率的因素有
温度
温度
和浓度
浓度
;(III)原电池是一种将
化学
化学
能转化为电
电
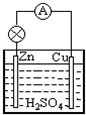
能的装置.在Cu-Zn原电池中,Zn极发生氧化
氧化
反应,电极反应式为Zn-2e-=Zn2+
Zn-2e-=Zn2+
.分析:(I)根据化合价的变化判断;
(II)通过实验现象判断影响反应速率的因素;
(III)根据原电池的定义、正负极反应的反应类型判断并写出相应的反应式.
(II)通过实验现象判断影响反应速率的因素;
(III)根据原电池的定义、正负极反应的反应类型判断并写出相应的反应式.
解答:解:(I)Fe2O3+2Al
2Fe+Al2O3,该反应中元素的化合价变化为:Fe2O3→Fe,铁元素由+3价→0价,得电子发生还原反应,所以Fe2O3是氧化剂;Al→Al2O3,铝元素由0价→+3价,失电子发生氧化反应,所以Al是还原剂.
故答案为:Fe2O3;Al.
(II)Zn粒和稀盐酸反应一段时间后,反应速率会减慢,当加热或加入浓盐酸后,反应速率明显加快.根据此现象判断,反应速率与反应物的浓度、温度有关.
故答案为:温度;浓度.
(III)原电池的定义:把化学能转变为电能的装置;在Cu-Zn原电池中,Zn失电子变成离子进入溶液,所以锌发生氧化反应,电极反应式为Zn-2e-=Zn2+;
故答案为:化学;电;氧化;Zn-2e-=Zn2+.
| ||
故答案为:Fe2O3;Al.
(II)Zn粒和稀盐酸反应一段时间后,反应速率会减慢,当加热或加入浓盐酸后,反应速率明显加快.根据此现象判断,反应速率与反应物的浓度、温度有关.
故答案为:温度;浓度.
(III)原电池的定义:把化学能转变为电能的装置;在Cu-Zn原电池中,Zn失电子变成离子进入溶液,所以锌发生氧化反应,电极反应式为Zn-2e-=Zn2+;
故答案为:化学;电;氧化;Zn-2e-=Zn2+.
点评:本题考查了氧化还原反应、反应速率的影响因素、原电池工作原理等基础知识,要注意的是:浓度对化学反应速率的影响的使用范围是溶液或气体,对固体或纯液体不适用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

 A~I分别表示中学化学中常见的一种物质,它们之间相互转化关系如图所示(部分反应物、生成物没有列出),且已知A、B、C、D、E、F六种物质中均含同一种元素,A、I是两种常见的金属单质.H在常温下是一种常见的非金属气态单质.
A~I分别表示中学化学中常见的一种物质,它们之间相互转化关系如图所示(部分反应物、生成物没有列出),且已知A、B、C、D、E、F六种物质中均含同一种元素,A、I是两种常见的金属单质.H在常温下是一种常见的非金属气态单质. 。
。