题目内容
某混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种。若该气体为无色气体,且通过品红溶液后,品红溶液褪色,剩余气体与空气接触时,很快变为红棕色。下列判断正确的是
| A.肯定只有NO | B.肯定有SO2和O2 |
| C.可能有Cl2和O2 | D.肯定没有Cl2、O2和NO2 |
D
解析试题分析:Cl2是黄绿色的气体NO2是红棕色的气体,该气体为无色气体说明没有氯气和NO2气体。NO是无色气体,它与氧气发生反应:2NO+O2=2NO2;剩余气体与空气接触时,很快变为红棕色,说明含有NO气体,没有O2。。通过品红溶液后,品红溶液褪色说明含有SO2,因为SO2有漂白性,能使品红溶液褪色。所以该气体中一定含有SO2、NO,一定不含Cl2、O2、NO2。选项为:D.
考点:考查气体物质的性质及共存问题的知识。

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
某同学用滤纸折成一个纸蝴蝶并喷洒一种溶液(保持湿润),挂在铁架台上。另取一只盛某种溶液的烧杯,放在纸蝴蝶的下方(如图)。过一会,发现纸蝴蝶变为蓝色。下表的组合中,能够实现上述变化的是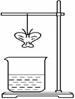
| | A | B | C | D |
| 纸蝴蝶上的喷洒液 | 酚酞 | KI-淀粉溶液 | 石蕊 | 品红 |
| 小烧杯中的溶液 | 浓氨水 | 浓氯水 | 浓盐酸 | 浓硫酸 |
下列说法正确的是
| A.水泥、玻璃、陶瓷、水晶都属于硅酸盐产品 |
| B.二氧化碳通入水玻璃可以得到硅酸 |
| C.因为高温时二氧化硅与碳酸钠反应放出二氧化碳,所以酸性硅酸比碳酸强 |
| D.可以用澄清石灰水鉴别SO2和CO2 |
下列实验现象和结论一致,正确的是
| A.氯水加入有色布条,有色布条褪色,说明溶液中有Cl2存在 |
| B.氯水溶液呈黄绿色,有刺激性气味,说明有Cl2存在 |
| C.氯水加入盐酸酸化的AgNO3溶液产生白色沉淀,说明有Cl-存在 |
| D.氯水加入NaOH溶液,氯水黄绿色消失,说明有HClO存在 |
SO2通入下列溶液中,溶液褪色或变浅,说明SO2具有漂白作用的组合是
①KMnO4(H+,aq) ②溴水 ③碘水 ④氯水 ⑤Fe3+(aq)
| A.①⑤ | B.②③④ | C.全部 | D.都不是 |
如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了。则液体A和气体B的组合不可能是下列的:
| A.氢氧化钠溶液、二氧化碳 | B.硝酸银溶液、氯化氢 |
| C.水、氨气 | D.水、一氧化碳 |
下列说法不正确的有( )
| A.硅酸盐工业使用的每一种原料中都必须含有硅 |
| B.水泥、普通玻璃都是混合物 |
| C.生产水泥、玻璃都需用石灰石 |
| D.用纯净的石英可制成石英玻璃,它的膨胀系数小,常用来制造耐高温的化学仪器 |
下列现象不能用于检验NH3的是
| A.气体遇浓盐酸产生白烟 |
| B.气体使湿润的蓝色石蕊试纸变红 |
| C.气体通人酚酞溶液中,溶液变红 |
| D.气体使湿润的红色石蕊试纸变蓝 |
为除去镀在铝表面的铜镀层,可选用的试剂是( )
| A.稀HNO3 | B.浓HNO3 | C.浓H2SO4 | D.浓HCl |