题目内容
12.现有0.300LH2SO4和Na2SO4的混合溶液,其中H2SO4的物质的量浓度为1.00mol/L,Na2SO4的物质的量浓度为0.800mol/L.欲使Na2SO4的浓度变为0.500mol/L,应将溶液稀释至480毫升,若要同时使H2SO4的浓度变为2.00mol•L-1应向原溶液中加入98%(p=1.84g/cm3)的浓硫酸36毫升.分析 硫酸钠的物质的量不变,根据稀释定律,计算混合后溶液的体积;
由混合后硫酸的浓度,根据n=cV计算出混合后n(H2SO4),进而计算需要加入的硫酸的物质的量,根据c=$\frac{1000ρω}{M}$,计算98%的H2SO4溶液的物质的量浓度,再根据V=$\frac{n}{C}$计算需要加入的98%的H2SO4溶液的体积.
解答 解:硫酸钠的物质的量不变,根据稀释定律,令混合后溶液的体积为V,则:
0.30L×0.8mol•L-1=V×0.5mol•L-1,解得V=0.48L=480mL.即稀释后溶液体积为480mL.
稀释前后硫酸的物质的量不变,均为n(H2SO4)=0.30L×1mol•L-1=0.3mol,
而要想H2SO4的浓度变为2.00mol•L-1,则溶液中硫酸的物质的量n=CV=2mol/L×0.48L=0.96mol.
故需要加入的硫酸的物质的量为:0.96mol-0.3mol=0.66mol,
由于98%的H2SO4溶液的物质的量浓度c=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,
故需要加入98%的H2SO4溶液的体积V=$\frac{0.66mol}{18.4mol/L}$=0.036L=36mL.
故答案为:480,36.
点评 本题考查物质的量浓度的有关计算,难度中等,根据硫酸钠的物质的量不变计算混合后溶液的体积是关键.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
20.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4L苯的分子数约为NA个 | |
| B. | 常温下,在1moLCnH2n+2中含有共价键数(3n+1)NA | |
| C. | 标准状况下,17g NH3所含共价键数为NA个 | |
| D. | 标准状况下,2.24L NO与1.12LO2混合后,所含分子数为0.2NA |
7.下列说法中正确的是( )
| A. | 两种盐溶液混合就一定能生成两种新盐 | |
| B. | 金属和酸都能发生置换反应生成氢气 | |
| C. | 金属与盐溶液反应一定得到金属和新盐 | |
| D. | 碱性氧化物加入水后不一定生成碱 |
17.在2L的密闭容器内充人2moL N2和3mo1 H2,在一定的条件下使其反应,5min后测得反应混合物中NH3占25%(体积分数),则此时用N2表示的化学反应速率是( )
| A. | 0.05mol/(L•min ) | B. | 0.1mol/(L•min ) | C. | 0.125mol/(L•min ) | D. | 0.25mol/(L•min ) |
4.下列说法正确的是( )
| A. | Cl2的摩尔质量等于它的相对分子质量 | |
| B. | 1mol H2O的质量是18g | |
| C. | 氧气的摩尔质量是32g | |
| D. | 2g H2含1mol H |
9.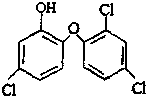 三氯生是一种抗菌剂,其结构如下图所示,遇含氯自来水能生成有毒的三氯甲烷.下列说法不正确的是( )
三氯生是一种抗菌剂,其结构如下图所示,遇含氯自来水能生成有毒的三氯甲烷.下列说法不正确的是( )
 三氯生是一种抗菌剂,其结构如下图所示,遇含氯自来水能生成有毒的三氯甲烷.下列说法不正确的是( )
三氯生是一种抗菌剂,其结构如下图所示,遇含氯自来水能生成有毒的三氯甲烷.下列说法不正确的是( )| A. | 三氯生的分子式是C12H6Cl3O2 | |
| B. | 三氯甲烷与甲烷均无同分异构体 | |
| C. | 1 mol三氯生最多能与6 mol H2反应 | |
| D. | 三氯生它的相对分子质量为289.5g/mol |
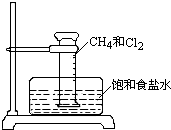 某课外活动小组利用如图所示装置探究甲烷于氯气的反应.根据题意,回答下列问题:
某课外活动小组利用如图所示装置探究甲烷于氯气的反应.根据题意,回答下列问题: