题目内容
已知含氧酸中,只有H原子与O原子相连时,才能在水溶液中电离出H+。次磷酸与足量的氢氧化钠反应的产物为NaH2PO2,又知均为0.1 mol·L-1的次磷酸(H3PO2)与盐酸相比前者导电能力弱,据此判断,下列说法正确的是( )
A.次磷酸是一种二元弱酸,在水中的电离方程式为:H3PO2![]() 2 H++
2 H++![]()
B.次磷酸的结构中,只有一个H原子与O原子直接相连
C.次磷酸是一元弱酸,在水中的电离方程式为:H3PO2![]() H++
H++![]()
D.0.1 mol·L-1次磷酸可与等体积的0.2 mol·L-1氢氧化钠溶液完全中和
BC
解析:
根据与NaOH反应的生成物可判断次磷酸是一元酸,如果次磷酸为强酸,则应完全电离,与盐酸导电性相同,但由于其导电能力弱,故为弱电解质。

练习册系列答案
相关题目

 )
)
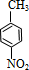
 +HOCH2CH2Cl
+HOCH2CH2Cl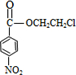 +H2O
+H2O




 )
)
 +HOCH2CH2Cl
+HOCH2CH2Cl H++H2PO2-
H++H2PO2-  H++H2PO2-
H++H2PO2-