题目内容
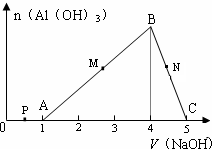
向盐酸和AlCl3的混合溶液中逐滴加入NaOH溶液至过量,生成沉淀Al(OH)3的量随着加入NaOH溶液体积的变化关系如图所示,下列说法正确的是

- A.在a点对应的溶液中,加入Mg2+、I-、NH4+、NO3―离子仍能大量共存
- B.图中B→C的过程中,实际发生的离子方程式为Al(OH)3+OH-=AlO2-+2H2O
- C.若b、c的纵坐标数值相同,则横坐标数值之比为1:3
- D.原溶液中盐酸和AlCl3物质的量的浓度之比为1:3
B
氢氧化钠首先和盐酸反应,然后再和氯化铝反应生成氢氧化铝沉淀。氢氧化钠过量则再溶解氢氧化铝,所以选项B正确。根据图像可知,a点溶液显酸性,而在酸性溶液中NO3-能氧化I-,选项A不正确;根据图像可知,选项C不正确。中和盐酸消耗的氢氧化钠是生成氢氧化铝消耗的氢氧化钠的1/3,所以盐酸和氯化铝的浓度之比是1︰1,选项D不正确。答案选B。
氢氧化钠首先和盐酸反应,然后再和氯化铝反应生成氢氧化铝沉淀。氢氧化钠过量则再溶解氢氧化铝,所以选项B正确。根据图像可知,a点溶液显酸性,而在酸性溶液中NO3-能氧化I-,选项A不正确;根据图像可知,选项C不正确。中和盐酸消耗的氢氧化钠是生成氢氧化铝消耗的氢氧化钠的1/3,所以盐酸和氯化铝的浓度之比是1︰1,选项D不正确。答案选B。

练习册系列答案
相关题目
 向盐酸和AlCl3的混合溶液中逐滴加入NaOH溶液至过量,生成沉淀Al(OH)3的量随着加入NaOH溶液体积的变化关系如图所示,下列说法正确的是( )
向盐酸和AlCl3的混合溶液中逐滴加入NaOH溶液至过量,生成沉淀Al(OH)3的量随着加入NaOH溶液体积的变化关系如图所示,下列说法正确的是( )

